Hvorfor er MgCl2 et bedre koaguleringsmiddel end Kcl for AS2S3 sol?
Derudover er MgCl2 et mere opløseligt salt end KCl. Det betyder, at det kan bruges i højere koncentrationer, hvilket også fører til en mere effektiv koagulation.
Endelig er MgCl2 billigere end KCl. Dette gør det til et mere økonomisk valg til brug som koaguleringsmiddel.
Her er en mere detaljeret forklaring af koagulationsprocessen:
1. Når MgCl2 tilsættes til AS2S3-solen, tiltrækkes Mg2+-ionerne til de negativt ladede AS2S3-partikler.
2. Mg2+-ionerne danner et lag af positiv ladning omkring AS2S3-partiklerne, som neutraliserer den negative ladning på partiklerne.
3. Dette får AS2S3-partiklerne til at komme tættere på hinanden og kollidere med hinanden.
4. Kollisionerne får AS2S3-partiklerne til at klæbe sammen og danne større partikler.
5. De større partikler sætter sig ud af opløsningen, som er kendt som koagulering.
Ladningstætheden af de koagulerende ioner er en vigtig faktor til at bestemme effektiviteten af koaguleringsprocessen. Jo højere ladningstætheden er, jo stærkere tiltrækkes ionerne af de modsat ladede partikler, hvilket fører til mere effektiv koagulering.
Opløseligheden af koaguleringssaltet er også en vigtig faktor. Jo mere opløseligt saltet er, jo højere koncentration kan der bruges, hvilket også fører til en mere effektiv koagulation.
Omkostningerne ved koaguleringsmidlet er også en vigtig faktor. MgCl2 er billigere end KCl, hvilket gør det til et mere økonomisk valg til brug som koaguleringsmiddel.
Som konklusion er MgCl2 et bedre koaguleringsmiddel end KCl for AS2S3 sol, fordi det har en højere ladningstæthed, er mere opløseligt og er billigere.
Sidste artikelHvad har den største formelmasse LiCl NaCl KCl MgCl2.?
Næste artikelHvilket grundstof er altid til stede i sulfider?
 Varme artikler
Varme artikler
-
 Fremstilling af polymerstrukturer hurtigere - to processer i en maskineMålet er at bruge kombimaskinen til at producere forgrenede mikrorør samt komplette mikrofluidiske systemer. Kredit:Fraunhofer ILT, Aachen, Tyskland Enten hurtigt eller præcist - begge dele kan ik
Fremstilling af polymerstrukturer hurtigere - to processer i en maskineMålet er at bruge kombimaskinen til at producere forgrenede mikrorør samt komplette mikrofluidiske systemer. Kredit:Fraunhofer ILT, Aachen, Tyskland Enten hurtigt eller præcist - begge dele kan ik -
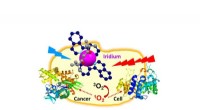 Kræftceller ødelagt med metal fra asteroiden, der dræbte dinosaurerneDiagram, der viser iridium, der angriber en kræftcelle ved at få den til at producere singlet-ilt. Kredit:University of Warwick Kræftceller kan målrettes og ødelægges med metallet fra asteroiden,
Kræftceller ødelagt med metal fra asteroiden, der dræbte dinosaurerneDiagram, der viser iridium, der angriber en kræftcelle ved at få den til at producere singlet-ilt. Kredit:University of Warwick Kræftceller kan målrettes og ødelægges med metallet fra asteroiden, -
 Ny enzymfri strategi til påvisning af organophosphor-pesticidresterFigur 1. Skematisk diagram af den hurtige visualisering og kvantificering af glyphosatrester ved ratiometrisk fluorescenssensor. Kredit:Zhang Qianru Højt forbrug og urimelige metoder har forårsaget
Ny enzymfri strategi til påvisning af organophosphor-pesticidresterFigur 1. Skematisk diagram af den hurtige visualisering og kvantificering af glyphosatrester ved ratiometrisk fluorescenssensor. Kredit:Zhang Qianru Højt forbrug og urimelige metoder har forårsaget -
 Forskere renser dramatisk op i ammoniakproduktionen og reducerer omkostningerneSWAP-processen i aktion. Den omdanner effektivt 90 procent af råmaterialet til ammoniak på én gang, hvorimod Haber-Bosch-processen kun konverterer 10 pct. Kredit:2019 Yoshiaki Nishibayashi Ammonia
Forskere renser dramatisk op i ammoniakproduktionen og reducerer omkostningerneSWAP-processen i aktion. Den omdanner effektivt 90 procent af råmaterialet til ammoniak på én gang, hvorimod Haber-Bosch-processen kun konverterer 10 pct. Kredit:2019 Yoshiaki Nishibayashi Ammonia
- Brazils Bolsonaro under pres for at beskytte Amazon
- Skolezoneinddeling kan øge motionsfrekvensen for unge
- Ny kemi til ultratynde gassensorer
- Hvordan smarte byer kan tjene borgerne
- Fiberoptiske vibrationssensorer kan forhindre togulykker
- Team identificerer skjulte spor til gamle superkontinenter, bekræfter Pannotia


