Hvad sker der, når man sænker temperaturen på en gas?
1. Volumenfald:Ifølge Charles's lov (også kendt som volumenloven) er volumenet af en gas direkte proportional med dens temperatur, når trykket forbliver konstant. Når temperaturen falder, har gaspartiklerne mindre termisk energi, hvilket resulterer i et fald i deres kinetiske energi. Denne reduktion i energi fører til et fald i den gennemsnitlige afstand mellem gaspartikler og som følge heraf en reduktion i det volumen, der optages af gassen.
2. Trykfald:Hvis volumenet af en gas falder, mens mængden af gas og temperatur forbliver konstant, falder trykket af gassen også. Dette forhold er beskrevet af Boyles lov, som siger, at trykket af en gas er omvendt proportional med dens volumen, når temperaturen og mængden af gas er konstant. Efterhånden som volumenet falder, falder trykket fra gaspartiklerne pr. arealenhed.
3. Densitetsforøgelse:Densitet er defineret som masse pr. volumenhed. Når temperaturen af en gas falder, falder dens volumen, mens massen af gassen forbliver den samme. Derfor stiger gassens densitet, fordi massen fordeles over et mindre volumen.
4. Molekylær bevægelse:Nedsættelse af temperaturen på en gas får gaspartiklernes gennemsnitlige kinetiske energi til at falde. Som følge heraf bevæger gasmolekylerne sig langsommere, og deres kollisioner med hinanden og beholdervæggene bliver mindre hyppige og mindre energiske. Dette fald i molekylær bevægelse kan føre til en ændring i gassens fysiske egenskaber og adfærd.
5. Flydning og størkning:Hvis temperaturen af en gas er tilstrækkeligt reduceret, kan den nå et punkt, hvor den kondenserer til en væske eller endda størkner til en fast tilstand. Denne faseovergangsproces opstår, når gaspartiklerne mister nok energi til at overvinde deres tendens til at forblive i den gasformige tilstand og overgå til en mere kondenseret flydende eller fast fase.
Det er vigtigt at bemærke, at de specifikke virkninger af faldende temperatur på en gas kan variere afhængigt af gassens startbetingelser og omfanget af temperaturændringen.
 Varme artikler
Varme artikler
-
 Forskere skaber nye materialer, der kan øge stabiliteten af perovskit-solcellerTværbindingseffekt giver modstand mod de nye forbindelser syntetiseret af litauiske kemikere. Kredit:And Unicorns En gruppe kemikere fra Kaunas University of Technology i Litauen, udviklerne af ads
Forskere skaber nye materialer, der kan øge stabiliteten af perovskit-solcellerTværbindingseffekt giver modstand mod de nye forbindelser syntetiseret af litauiske kemikere. Kredit:And Unicorns En gruppe kemikere fra Kaunas University of Technology i Litauen, udviklerne af ads -
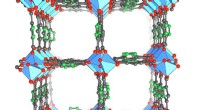 I ørkenforsøg, næste generations vandopsamler leverer frisk vand fra luftenKrystalstrukturen af de nyeste, aluminiumsbaseret metal-organisk ramme, MOF-303, som fanger dobbelt så meget vand som den tidligere MOF, der blev brugt i vandhøsteren. Kredit:Yaghi lab, UC Berkeley
I ørkenforsøg, næste generations vandopsamler leverer frisk vand fra luftenKrystalstrukturen af de nyeste, aluminiumsbaseret metal-organisk ramme, MOF-303, som fanger dobbelt så meget vand som den tidligere MOF, der blev brugt i vandhøsteren. Kredit:Yaghi lab, UC Berkeley -
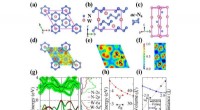 Maskinlæring forudsagde et superhårdt wolframnitrid med høj energidensitetKrystalstruktur og teoretiske elektroniske strukturer af nye W-N faser. Kredit:©Science China Press Selvom maskinlæring har været vellykket i mange aspekter, dets anvendelse i forudsigelser af kry
Maskinlæring forudsagde et superhårdt wolframnitrid med høj energidensitetKrystalstruktur og teoretiske elektroniske strukturer af nye W-N faser. Kredit:©Science China Press Selvom maskinlæring har været vellykket i mange aspekter, dets anvendelse i forudsigelser af kry -
 Ved at kombinere billige og sikre sorte og hvide materialer skabes farverige pigmenterFigur 1:Fotografier af sfæriske kolloide krystaller sammensat af fine silicapartikler eller fine silicapartikler belagt med Fe - TA film med sort og hvid baggrund:(a) Et system, der anvender fine sili
Ved at kombinere billige og sikre sorte og hvide materialer skabes farverige pigmenterFigur 1:Fotografier af sfæriske kolloide krystaller sammensat af fine silicapartikler eller fine silicapartikler belagt med Fe - TA film med sort og hvid baggrund:(a) Et system, der anvender fine sili
- Forskere sporer atmosfærisk stigning i CO2 under deglaciation til det dybe Stillehav
- Steder at finde Flintstones
- Mølleproducent Vestas leverer rekordordrebog
- Den usikre enhjulede cykel, der lærte sig selv, og hvordan den hjælper AI med at træffe gode besl…
- At modtage weekendmad forbedrer skolegangen blandt børn, der lever med sult
- Hvad er der med de seneste vilde tornadoer? Ekspert vejer ind


