Hvad er forskellen mellem faste stoffer og væsker?
Form og volumen
Faste stoffer har en bestemt form og volumen, mens væsker har en bestemt volumen, men ingen bestemt form. Dette skyldes, at molekylerne i en væske ikke er så stærkt bundet sammen som molekylerne i et fast stof. Dette gør det muligt for molekylerne i en væske at bevæge sig mere frit, hvilket betyder, at en væske kan flyde og tage form af sin beholder.
Tæthed
Faste stoffer er generelt tættere end væsker, hvilket betyder, at de har mere masse pr. volumenhed. Dette skyldes, at molekylerne i et fast stof er tættere pakket sammen end molekylerne i en væske.
Smeltning og frysning
Faste stoffer kan smeltes til væsker ved at opvarme dem, og væsker kan fryses til faste stoffer ved at afkøle dem. Den temperatur, hvor et fast stof smelter eller en væske fryser, kaldes smeltepunktet eller frysepunktet. Et stofs smeltepunkt og frysepunkt er den samme temperatur.
Damptryk
Et stofs damptryk er det tryk, som dampen af stoffet udøver, når det er i ligevægt med dets flydende eller faste fase. En væskes damptryk er altid højere end et fast stofs damptryk. Dette skyldes, at molekylerne i en væske har mere energi end molekylerne i et fast stof, og det gør, at de lettere kan flygte fra væsken.
Viskositet
Viskositeten af en væske er dens modstand mod strømning. En væskes viskositet stiger med faldende temperatur. Det skyldes, at molekylerne i en væske er tættere pakket sammen ved lavere temperaturer, hvilket gør det sværere for dem at bevæge sig.
Eksempler på faste stoffer og væsker
Nogle eksempler på faste stoffer omfatter is, metal og træ. Nogle eksempler på væsker omfatter vand, mælk og olie.
 Varme artikler
Varme artikler
-
 Forskere observerer skiftet af Ras-protein i detaljerDaniel Mann, Klaus Gerwert og Carsten Kötting (fra venstre) implementerer en proces til afkodning, der letter beregningen af eksperimentelle data såsom infrarøde spektre og nukleare spinspektre inds
Forskere observerer skiftet af Ras-protein i detaljerDaniel Mann, Klaus Gerwert og Carsten Kötting (fra venstre) implementerer en proces til afkodning, der letter beregningen af eksperimentelle data såsom infrarøde spektre og nukleare spinspektre inds -
 Maskinindlæring revner krystalstrukturenes oxidationstilstandeKredit:CC0 Public Domain Kemiske grundstoffer udgør stort set alt i den fysiske verden. Fra 2016 vi kender til 118 elementer, som alle kan findes kategoriseret i det berømte periodiske system, der
Maskinindlæring revner krystalstrukturenes oxidationstilstandeKredit:CC0 Public Domain Kemiske grundstoffer udgør stort set alt i den fysiske verden. Fra 2016 vi kender til 118 elementer, som alle kan findes kategoriseret i det berømte periodiske system, der -
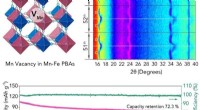 Forskning driver genopladelige batterier, der holder længereForskere udviklede et meget stabilt katodemateriale til natriumlagring. Kredit:SUTD Med den løbende forbedring af elektronik, udviklingen af højenergi-strømforsyninger er blevet et nøgleled i de
Forskning driver genopladelige batterier, der holder længereForskere udviklede et meget stabilt katodemateriale til natriumlagring. Kredit:SUTD Med den løbende forbedring af elektronik, udviklingen af højenergi-strømforsyninger er blevet et nøgleled i de -
 Bananplanteekstrakt kan være nøglen til mere cremet, længerevarende isSmå fibre ekstraheret fra bananplante rachis (cirklet) kunne hjælpe med at bremse issmeltningen. Kredit:Robin Zuluaga Gallego Ingen tvivl om det, is er en god fornøjelse på en varm dag. Det er, in
Bananplanteekstrakt kan være nøglen til mere cremet, længerevarende isSmå fibre ekstraheret fra bananplante rachis (cirklet) kunne hjælpe med at bremse issmeltningen. Kredit:Robin Zuluaga Gallego Ingen tvivl om det, is er en god fornøjelse på en varm dag. Det er, in


