Hvad er elektronerne i den indre skal?
De indre skaller er mærket efter deres nærhed til kernen, hvor den inderste skal betegnes som K-skallen, efterfulgt af L, M, N og så videre. Hver skal kan rumme et bestemt antal elektroner, baseret på kvantemekaniske principper.
* K shell: Dette er den inderste skal og kan rumme op til 2 elektroner.
* L skal: L-skallen er det andet energiniveau og kan rumme op til 8 elektroner (2s og 2p subshells).
* M shell: M-skallen er det tredje energiniveau og kan indeholde op til 18 elektroner (3s, 3p og 3d subshells).
* N shell: N-skallen er det fjerde energiniveau og kan rumme op til 32 elektroner (4s, 4p, 4d og 4f subshells).
Indre skalelektroner er generelt tættere bundet til kernen end ydre skalelektroner. Dette skyldes, at de oplever en stærkere elektrostatisk tiltrækningskraft fra kernen på grund af dens højere positive ladning. Jo tættere en elektron er på kernen, jo lavere er dens energi og jo stærkere holdes den.
Arrangementet og adfærden af indre skalelektroner spiller en afgørende rolle i forskellige atomare egenskaber og processer. De bidrager til den overordnede elektronkonfiguration af et grundstof og påvirker dets kemiske bindingsadfærd, atomstørrelse, ioniseringsenergi og andre grundlæggende egenskaber.
 Varme artikler
Varme artikler
-
 Sådan narre elektroner til at se krystallers skjulte ansigtEn nylonfiber (lyseblå), aflejret på kulstofbæreren (grå), løfter krystallen op (rød). Denne måde, krystallens sideflade bliver synlig for elektronstrålen (blå). Uden fiberen (højre figur), krystallen
Sådan narre elektroner til at se krystallers skjulte ansigtEn nylonfiber (lyseblå), aflejret på kulstofbæreren (grå), løfter krystallen op (rød). Denne måde, krystallens sideflade bliver synlig for elektronstrålen (blå). Uden fiberen (højre figur), krystallen -
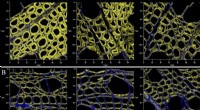 Kvantificering af ændringer i overfladekemi af træplanter under mikrobiel gæringORNL -forskere brugte sofistikerede laserscanningsteknikker til at sammenligne nedbrydningen af fermenteret populær (B) sammenlignet med ugæret populær (A), som de kvantificerede, for første gang, k
Kvantificering af ændringer i overfladekemi af træplanter under mikrobiel gæringORNL -forskere brugte sofistikerede laserscanningsteknikker til at sammenligne nedbrydningen af fermenteret populær (B) sammenlignet med ugæret populær (A), som de kvantificerede, for første gang, k -
 Forståelse og styring af det molekyle, der skabte universetMarcos Dantus, Universitets fremtrædende professor i kemi og fysik, har genskabt interstellare ioner med lasere. Kredit:MSU Trihydrogen, eller H 3 + , er anerkendt af videnskabsmænd som det mo
Forståelse og styring af det molekyle, der skabte universetMarcos Dantus, Universitets fremtrædende professor i kemi og fysik, har genskabt interstellare ioner med lasere. Kredit:MSU Trihydrogen, eller H 3 + , er anerkendt af videnskabsmænd som det mo -
 Fra skum til knogle:Plantecellulose kan bane vejen for sunde knogleimplantaterForskere behandlede nanokrystaller afledt af plantecellulose, så de kan forbindes og danne en stærk, men letvægtssvamp (en aerogel), der kan komprimere eller udvide sig efter behov for fuldstændigt at
Fra skum til knogle:Plantecellulose kan bane vejen for sunde knogleimplantaterForskere behandlede nanokrystaller afledt af plantecellulose, så de kan forbindes og danne en stærk, men letvægtssvamp (en aerogel), der kan komprimere eller udvide sig efter behov for fuldstændigt at
- En bedre måde at lave akryl på
- Tænd min bål:Sådan starter du fusionsenheder hver gang
- Hvilken organelle danner basis for cilia og flagella?
- Udvikling af et digitalt holografi-baseret multimodalt billeddannelsessystem til at visualisere leve…
- Sådan konverteres kortgitterkoordinater til Latitude & Longitude
- Ændring af klima, længere vækstsæsoner komplicerer udsigterne for nåleskove


