Hvad er drengeloven, hvordan forholder det sig til gasser?
Matematisk kan Boyles lov udtrykkes som:
```
P1V1 =P2V2
```
Hvor:
- P1 repræsenterer gassens begyndelsestryk
- V1 repræsenterer det indledende volumen af gassen
- P2 repræsenterer det endelige tryk af gassen
- V2 repræsenterer det endelige volumen af gassen
Denne ligning indikerer, at hvis trykket af en gas stiger, mens temperaturen forbliver konstant, falder gassens volumen forholdsmæssigt og omvendt. Omvendt, hvis volumenet af en gas stiger ved en konstant temperatur, falder trykket proportionalt.
For at illustrere dette princip skal du overveje et scenario, hvor du har en fast mængde gas fanget inde i en beholder med et bevægeligt stempel. Hvis du skubber stemplet indad og reducerer beholderens volumen, vil trykket af gassen stige tilsvarende for at opretholde det samme produkt af tryk og volumen. Omvendt, hvis du trækker stemplet udad og øger beholderens volumen, vil trykket af gassen falde for at bevare det samme produkt.
Boyles lov gælder for ideelle gasser, som er teoretiske gasser, der udviser perfekt adfærd og følger visse simplificerende antagelser. Det gælder dog en god tilnærmelse for mange rigtige gasser under forskellige forhold. Denne lov har praktiske anvendelser inden for områder som dykning, hvor forståelse af gasadfærd er afgørende, og i industrier, der bruger tryksatte gasser til forskellige operationer.
Sidste artikelHvad kan du udlede om massefylden, hvis en blok af stof flyder i vand?
Næste artikelHvad er atomer elektrisk?
 Varme artikler
Varme artikler
-
 Flyt over Rover:Der er et nyt snusende kraftcenter i nabolagetElefanten Kelly leder efter mad over øjenhøjde ved hjælp af sin snabel. Kredit:Thomas Spencer, CC-BY Nogle dyr har en superkraft i deres lugtesans. De udforsker, fortolke og forstå deres verden me
Flyt over Rover:Der er et nyt snusende kraftcenter i nabolagetElefanten Kelly leder efter mad over øjenhøjde ved hjælp af sin snabel. Kredit:Thomas Spencer, CC-BY Nogle dyr har en superkraft i deres lugtesans. De udforsker, fortolke og forstå deres verden me -
 Elektrospundne fibre væver nye medicinske innovationerElektrospundet fiber ligner et edderkoppespind. Kredit:Joseph Fuqua II/UC Creative Services Når du besøger Andrew Steckls laboratorium ved University of Cincinnati, du ser en ubeskrivelig glaskass
Elektrospundne fibre væver nye medicinske innovationerElektrospundet fiber ligner et edderkoppespind. Kredit:Joseph Fuqua II/UC Creative Services Når du besøger Andrew Steckls laboratorium ved University of Cincinnati, du ser en ubeskrivelig glaskass -
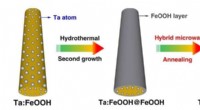 Et skridt tættere på praktisk solbrintproduktion via kunstfærdigt modificeret hæmatitfotoanodeFigur 1. Skematisk synteseprocedure af Ta:Fe2O3@Fe2O3 homojunction nanorods. Brug af hybrid mikrobølgeglødning, hæmatit homojunction nanorod syntetiseres ved hydrotermisk genvækst af tyndt FeOOH lag p
Et skridt tættere på praktisk solbrintproduktion via kunstfærdigt modificeret hæmatitfotoanodeFigur 1. Skematisk synteseprocedure af Ta:Fe2O3@Fe2O3 homojunction nanorods. Brug af hybrid mikrobølgeglødning, hæmatit homojunction nanorod syntetiseres ved hydrotermisk genvækst af tyndt FeOOH lag p -
 At få fermenterede mejeriprodukter til at smage bedreEmmental ost. Kredit:Wikipedia Forskere ved det tekniske universitet i München (TUM), Leibniz-instituttet for fødevaresystembiologi, og University of Hohenheim har udviklet en ny metodisk tilgang
At få fermenterede mejeriprodukter til at smage bedreEmmental ost. Kredit:Wikipedia Forskere ved det tekniske universitet i München (TUM), Leibniz-instituttet for fødevaresystembiologi, og University of Hohenheim har udviklet en ny metodisk tilgang
- Sådan finder du acceleration med hastighed & Distance
- Beskriv celledelingens funktioner i både encellede og flercellede organismer?
- Forskere opdager usædvanlige kvasipartikler i trelags grafen
- Forskere tager røntgenmål for at opdage ny brændstofkatalysator
- Hvad vil de første byer på Mars ligne?
- Fra sommerfuglens fløj til tornadoen:Forudsiger turbulens


