Hvad er oxidationstilstanden for sølv i opløsning?
For eksempel i sølvnitrat (AgNO3), som er et almindeligt sølvsalt, har sølvionen en oxidationstilstand på +1. Det skyldes, at nitrationen (NO3-) har en ladning på -1, og forbindelsen som helhed skal være neutral. Derfor skal sølvionen have en positiv ladning for at balancere den negative ladning af nitrationen.
Tilsvarende har sølvionerne i sølvsulfat (Ag2SO4) også en oxidationstilstand på +1. I dette tilfælde har hver sulfation (SO42-) en ladning på -2, og da der er to sølvioner for hver sulfation, skal sølvionerne hver have en ladning på +1 for at balancere den samlede ladning af forbindelsen.
Det er værd at bemærke, at sølv også kan udvise forskellige oxidationstilstande i visse forbindelser eller komplekser, såsom +2 eller endda højere i nogle sjældne tilfælde. Imidlertid er +1-oxidationstilstanden den mest almindelige og udbredte form for sølv i opløsning.
Sidste artikelHvad er grundvandets pH?
Næste artikelMed hensyn til periodisk lov, hvilke elementer ligner mest - natriumfosfor og svovl?
 Varme artikler
Varme artikler
-
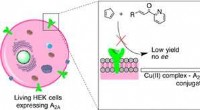 Kunstige enzymer udfører reaktioner på levende cellerKredit:American Chemical Society Naturen har udviklet tusindvis af enzymer for at lette de mange kemiske reaktioner, der finder sted inde i organismer for at opretholde liv. Nu, forskere har desig
Kunstige enzymer udfører reaktioner på levende cellerKredit:American Chemical Society Naturen har udviklet tusindvis af enzymer for at lette de mange kemiske reaktioner, der finder sted inde i organismer for at opretholde liv. Nu, forskere har desig -
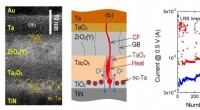 En optimeret struktur af memristiv enhed til neuromorfe computersystemerHøjopløselig transmissionselektronmikroskopibillede (a) og skematisk (b) af tværsnittet af flerlags memristive strukturen i området for den ledende filament (CF), afhængigheden af resistive tilstand
En optimeret struktur af memristiv enhed til neuromorfe computersystemerHøjopløselig transmissionselektronmikroskopibillede (a) og skematisk (b) af tværsnittet af flerlags memristive strukturen i området for den ledende filament (CF), afhængigheden af resistive tilstand -
 Kunstig receptor skelner mellem mandlige og kvindelige hormonerEn skematisk fremstilling af den selektive binding af testosteron fra en blanding af testosteron, progesteron, og beta-østradiol i vand. Receptoren har et indre hulrum med en diameter på cirka en nano
Kunstig receptor skelner mellem mandlige og kvindelige hormonerEn skematisk fremstilling af den selektive binding af testosteron fra en blanding af testosteron, progesteron, og beta-østradiol i vand. Receptoren har et indre hulrum med en diameter på cirka en nano -
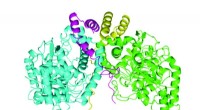 Hvilke bakterier kan lære os om bekæmpelse af atrazinkontamineringEt nyligt beskrevet proteinkompleks udfører et trin i bakteriel nedbrydning af herbicidet atrazin. De to AtzE -molekyler er i blå og grøn, og de to AtzG -molekyler er i gul og magenta. Kredit:Colin Sc
Hvilke bakterier kan lære os om bekæmpelse af atrazinkontamineringEt nyligt beskrevet proteinkompleks udfører et trin i bakteriel nedbrydning af herbicidet atrazin. De to AtzE -molekyler er i blå og grøn, og de to AtzG -molekyler er i gul og magenta. Kredit:Colin Sc
- Ny metode bruger ultraviolet lys til at kontrollere væskestrømmen og organisere partikler
- Cellulær mikroRNA-detektion med mirakler
- Twitter -direktør Dorsey udløser storm på sociale medier i Indien
- Marine Batteri Vs. Deep Cycle Battery
- Fremtidssikring af Great Lakes-regionen gennem klimaforskning
- Odysseys tre visninger af Mars månen Phobos


