Er svovldioxid en kovalent forbindelse?
I svovldioxid er svovlatomet og de to oxygenatomer kovalent bundet sammen ved at dele elektroner. Svovlatomet har seks valenselektroner, og hvert oxygenatom har seks valenselektroner. For at opnå en stabil elektronkonfiguration deler svovlatomet to af dets valenselektroner med hvert af oxygenatomerne, og hvert oxygenatom deler to af dets valenselektroner med svovlatomet. Dette resulterer i dannelsen af to S-O kovalente bindinger, der hver består af et fælles elektronpar.
Som følge af denne elektrondeling holdes svovl- og oxygenatomerne i svovldioxid sammen af stærke kovalente kræfter, hvilket giver anledning til molekylets stabilitet.
Sidste artikelHvad er formelenheden for H3O?
Næste artikelHvilket volumen er optaget af 2,4 mol klor?
 Varme artikler
Varme artikler
-
 Stærke kunstige kulfibermuskler kan løfte 12, 600 gange deres egen vægtZoom ind på den kulfiberforstærkede oprullede muskel med en diameter på 0,4 mm. Kredit:University of Illinois Department of Mechanical Science and Engineering Optrækket, en øvelse frygtet af de fl
Stærke kunstige kulfibermuskler kan løfte 12, 600 gange deres egen vægtZoom ind på den kulfiberforstærkede oprullede muskel med en diameter på 0,4 mm. Kredit:University of Illinois Department of Mechanical Science and Engineering Optrækket, en øvelse frygtet af de fl -
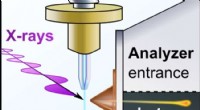 Hvordan dannes et metal?Skematisk billede af en flydende ammoniakmikrojet med opløste alkalimetaller, som målt ved BESSY II synkrotron i Berlin. Et billede af gylden metallisk ammoniak er afbildet i bunden af strålen. Kred
Hvordan dannes et metal?Skematisk billede af en flydende ammoniakmikrojet med opløste alkalimetaller, som målt ved BESSY II synkrotron i Berlin. Et billede af gylden metallisk ammoniak er afbildet i bunden af strålen. Kred -
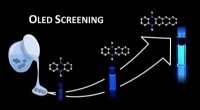 Molekylærbiblioteker for organiske lysdioderEn ny screeningsproces betyder, at lovende OLED -belysningsmaterialer kan identificeres mere effektivt. Kredit:AG Matthias Wagner Den stigende efterspørgsel efter stadig mere sofistikerede smartph
Molekylærbiblioteker for organiske lysdioderEn ny screeningsproces betyder, at lovende OLED -belysningsmaterialer kan identificeres mere effektivt. Kredit:AG Matthias Wagner Den stigende efterspørgsel efter stadig mere sofistikerede smartph -
 Termisk energilagring:Materiale absorberer varme, når det smelter og frigiver det, når det størkn…Venstre mod højre:Kandidatstuderende Cédric Viry, Professor Jeffrey Grossman, og postdoc Grace Han, sammen med deres samarbejdspartnere, bruger specialdesignede photoswitching-molekyler til at kontrol
Termisk energilagring:Materiale absorberer varme, når det smelter og frigiver det, når det størkn…Venstre mod højre:Kandidatstuderende Cédric Viry, Professor Jeffrey Grossman, og postdoc Grace Han, sammen med deres samarbejdspartnere, bruger specialdesignede photoswitching-molekyler til at kontrol
- Hvilke to planeter har store storms på dem?
- Spøgelsespartikel ML-model tillader fuld kvantebeskrivelse af den solvatiserede elektron
- Ikke al mælkeblomst er ens for æglæggende monarker, undersøgelse afslører
- Stærke kunstige kulfibermuskler kan løfte 12, 600 gange deres egen vægt
- Chandra påvisning af diskløse unge stjerner
- Svedesensor registrerer stressniveauer; Kan finde brug i rumforskning


