Hvorfor klormolekyler nedbrydes for at give Cl frie radikaler, forklar venligst i form af kc?
Cl2 (g) ⇌ 2 Cl (g)
Ligevægtskonstanten (Kc) for denne reaktion er givet ved udtrykket:
Kc =[Cl]^2/[Cl2]
hvor [Cl] er ligevægtskoncentrationen af frie klorradikaler og [Cl2] er ligevægtskoncentrationen af klormolekyler.
Ved en given temperatur bestemmer værdien af Kc i hvilket omfang Cl2-molekyler nedbrydes til frie Cl-radikaler. En højere Kc-værdi indikerer en større tendens for Cl2 til at dissociere, hvilket resulterer i en højere koncentration af frie Cl-radikaler ved ligevægt.
Faktorer, der påvirker værdien af Kc for nedbrydning af Cl2, omfatter temperatur og tryk. Generelt stiger Kc med stigende temperatur. Dette skyldes, at højere temperaturer giver mere energi til Cl2-molekylerne, hvilket giver dem mulighed for at overvinde den aktiveringsenergibarriere, der kræves for dissociation. Som et resultat dissocierer flere Cl2-molekyler til frie Cl-radikaler, hvilket fører til en højere ligevægtskoncentration af Cl.
På den anden side har tryk en relativt lille effekt på værdien af Kc for nedbrydning af Cl2. Dette skyldes, at reaktionen ikke involverer en væsentlig ændring i antallet af mol gas. Derfor påvirker ændringer i tryk ikke væsentligt reaktionens ligevægtsposition.
Sammenfattende er nedbrydningen af klormolekyler til dannelse af frie klorradikaler en temperaturafhængig proces, der er styret af ligevægtskonstanten Kc. Højere temperaturer begunstiger dannelsen af frie Cl-radikaler, mens tryk har en relativt lille indflydelse på reaktionens ligevægtsposition.
Sidste artikelHvor mange mol ammoniak produceres der af 12,0 brint?
Næste artikelHvor meget masse har 1 mol svovlatomer?
 Varme artikler
Varme artikler
-
 Ekspert:Brug af kulstof er nøglen til at dekarbonisere økonomiMatteo Pasquali fra Rice University er kemiingeniør, kemiker, materialeforsker og direktør for forskningsinitiativet Carbon Hub. Kredit:Jeff Fitlow/Rice University Rice Universitys kulstofmaterial
Ekspert:Brug af kulstof er nøglen til at dekarbonisere økonomiMatteo Pasquali fra Rice University er kemiingeniør, kemiker, materialeforsker og direktør for forskningsinitiativet Carbon Hub. Kredit:Jeff Fitlow/Rice University Rice Universitys kulstofmaterial -
 Ny teknik til at karakterisere kemisk sammensætning og struktur af prøverKredit:Forance, Shutterstock Raman -spektroskopi er en væsentlig teknik, der bruges til undersøgelse af materialer - herunder nanostrukturer - og biologiske systemer til at analysere deres sammens
Ny teknik til at karakterisere kemisk sammensætning og struktur af prøverKredit:Forance, Shutterstock Raman -spektroskopi er en væsentlig teknik, der bruges til undersøgelse af materialer - herunder nanostrukturer - og biologiske systemer til at analysere deres sammens -
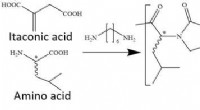 Pepsin-nedbrydelig plast af bio-nyloner fra itaconsyre og aminosyrerFigur 1. Udviklingsstrategi for pepsinnedbrydelige BioNyloner fra itaconsyre og leucin. Kredit:Tatsuo Kaneko og Mohammad Asif Ali fra JAIST Aktuelt tilgængeligt konventionelt nylon såsom nylon 6,
Pepsin-nedbrydelig plast af bio-nyloner fra itaconsyre og aminosyrerFigur 1. Udviklingsstrategi for pepsinnedbrydelige BioNyloner fra itaconsyre og leucin. Kredit:Tatsuo Kaneko og Mohammad Asif Ali fra JAIST Aktuelt tilgængeligt konventionelt nylon såsom nylon 6, -
 Kunstigt producerede celler kommunikerer med hinandenFørste forfatter Aurore Dupin og prof. Friedrich Simmel ved fluorescensmikroskopet. De bruger mikromanipulatorer til at samle deres kunstige cellesystemer. Kredit:Uli Benz / TUM Friedrich Simmel o
Kunstigt producerede celler kommunikerer med hinandenFørste forfatter Aurore Dupin og prof. Friedrich Simmel ved fluorescensmikroskopet. De bruger mikromanipulatorer til at samle deres kunstige cellesystemer. Kredit:Uli Benz / TUM Friedrich Simmel o
- Hvad er effekten af forskellige overfladetyper på en bolds rulleafstand?
- Hvordan laver asparges lugt?
- Fangst af fossile fisk fra Kina omfatter de ældste tænder nogensinde
- Forskere forbedrer metoden til at sondere halvledende krystaller med lys for at opdage defekter og u…
- Succesfuld syntese af spiralformet ledende polymerer med cirkulær polarisationsaktivitet som reakti…
- Forskel mellem natriumchlorid og natriumchlorid


