Hvor meget sølvfosfat produceres, hvis 10 g acetat reagerer med overskydende natriumfosfat?
2AgCH3COO(aq) + Na3PO4(aq) → Ag3PO4(s) + 3CH3COONa(aq)
Ud fra ligningen kan vi se, at 2 mol sølvacetat reagerer med 1 mol natriumphosphat. Den molære masse af sølvacetat er 166,91 g/mol, og den molære masse af natriumphosphat er 163,94 g/mol. Derfor er 10 g sølvacetat:
10 g / 166,91 g/mol =0,0599 mol
Da vi har overskydende natriumfosfat, kan vi antage, at alt sølvacetat vil reagere. Ifølge den afbalancerede ligning vil 0,0599 mol sølvacetat producere 0,0299 mol sølvfosfat. Den molære masse af sølvfosfat er 418,67 g/mol, så massen af produceret sølvfosfat vil være:
0,0299 mol * 418,67 g/mol =12,54 g
Hvis 10 g sølvacetat reagerer med overskydende natriumfosfat, vil der derfor blive produceret 12,54 g sølvfosfat.
 Varme artikler
Varme artikler
-
 En bioplast afledt af sojaprotein, som kan absorbere op til 40 gange sin egen vægtDette nye produkt, som er organisk og biologisk nedbrydeligt, er miljøvenlig. Af den grund, eksperterne undersøger brugen af det inden for havebrug, specifikt som et råmateriale til fremstilling af
En bioplast afledt af sojaprotein, som kan absorbere op til 40 gange sin egen vægtDette nye produkt, som er organisk og biologisk nedbrydeligt, er miljøvenlig. Af den grund, eksperterne undersøger brugen af det inden for havebrug, specifikt som et råmateriale til fremstilling af -
 Omdanne affald til biobaserede kemikalierKredit:Pixabay/CC0 Public Domain Forskere ved Berkeley Lab har transformeret lignin, et affaldsprodukt fra papirindustrien, til en forløber for et nyttigt kemikalie med en bred vifte af potentiell
Omdanne affald til biobaserede kemikalierKredit:Pixabay/CC0 Public Domain Forskere ved Berkeley Lab har transformeret lignin, et affaldsprodukt fra papirindustrien, til en forløber for et nyttigt kemikalie med en bred vifte af potentiell -
 Forskere kan forudsige og designe enkeltatomkatalysatorer til vigtige kemiske reaktionerKredit:CC0 Public Domain Forskere ved Tufts University, University College London (UCL), Cambridge University og University of California i Santa Barbara har vist, at en katalysator faktisk kan væ
Forskere kan forudsige og designe enkeltatomkatalysatorer til vigtige kemiske reaktionerKredit:CC0 Public Domain Forskere ved Tufts University, University College London (UCL), Cambridge University og University of California i Santa Barbara har vist, at en katalysator faktisk kan væ -
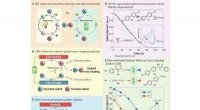 Metode til at anvende mikrofluidiske elektrokemiske teknologier til redox-neutrale reaktioner med en…Baggrund og mikrofluidisk redox-neutral elektrokemi (μRN-eChem). Kredit: Videnskab (2020). DOI:10.1126/science.aba3823 Et team af kemikere og ingeniører ved MIT har fundet en ny måde at anvende m
Metode til at anvende mikrofluidiske elektrokemiske teknologier til redox-neutrale reaktioner med en…Baggrund og mikrofluidisk redox-neutral elektrokemi (μRN-eChem). Kredit: Videnskab (2020). DOI:10.1126/science.aba3823 Et team af kemikere og ingeniører ved MIT har fundet en ny måde at anvende m
- Forskere udvikler luftkvalitetssensor, der kan redde liv for babyer og astmapatienter
- Nanoingeniører kan printe 3D-mikrostrukturer på få sekunder
- Fire måleenheder i det metriske system er ved at blive ændret
- Nyt kig på satellitdataspørgsmåls skala af Kinas skovrejsningssucces
- Små mikroplastik slipper ikke længere gennem sprækkerne med en ny metode til påvisning
- 737 MAX testflyvning endnu ikke planlagt:FAA


