1. Den ioniske forbindelse fremstillet af aluminium og klor har formlen AlCl3. Forklar i detaljer, hvorfor det er den rigtige formel?
1. Valenselektroner:
- Aluminium (Al) tilhører gruppe 13 (eller IIIA) i det periodiske system og har et atomnummer på 13.
- Klor (Cl) tilhører gruppe 17 (eller VIIA) i det periodiske system og har et atomnummer på 17.
- Aluminium har tre valenselektroner i sit yderste energiniveau (3 valenselektroner), mens klor har syv valenselektroner (7 valenselektroner).
2. Ionisk binding:
- Ionbinding opstår, når en eller flere elektroner overføres fra et atom til et andet, hvilket resulterer i dannelsen af positivt ladede ioner (kationer) og negativt ladede ioner (anioner).
- I tilfælde af AlCl3 mister aluminium (Al) sine tre valenselektroner til klor (Cl), hvilket resulterer i dannelsen af positivt ladede aluminiumioner (Al3+) og negativt ladede klorioner (Cl-).
3. Formelbestemmelse:
- For at bestemme den rigtige formel skal vi afbalancere ladningerne af ionerne. Da aluminium mister tre elektroner, og hver klor får en elektron, har vi brug for tre klorioner (3Cl-) for at balancere ladningen af en aluminiumion (Al3+).
- Derfor bliver formlen AlCl3, hvor underskriften "3" angiver, at der er tre kloratomer for hvert aluminiumatom i forbindelsen.
Det er vigtigt at bemærke, at formlen AlCl3 repræsenterer det enkleste hele talforhold af ioner, der opfylder valenskravene og ladningsbalancen. Dette er grunden til, at formlen AlCl3 er korrekt, snarere end andre mulige formler som AlCl2 eller Al2Cl6, som ikke ville balancere ladningerne korrekt.
Sidste artikelhvad er hårdheden af feldspat?
Næste artikelHvad er den kemiske formel for natriummonosulfat?
 Varme artikler
Varme artikler
-
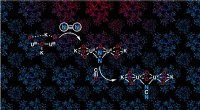 Nitrogenfiksering under omgivende forholdDen oxo-broforbundne uranforbindelse fanger dinitrogen og omdanner dinitrogen og kulilte til cyanamid. Kredit:Marta Falcone/Marinella Mazzanti/EPFL Rigelig i atmosfæren, kvælstof bruges sjældent t
Nitrogenfiksering under omgivende forholdDen oxo-broforbundne uranforbindelse fanger dinitrogen og omdanner dinitrogen og kulilte til cyanamid. Kredit:Marta Falcone/Marinella Mazzanti/EPFL Rigelig i atmosfæren, kvælstof bruges sjældent t -
 Forskere udvikler diagnostisk værktøj til påvisning af cryptosporidiumIngeniørdoktorand George Luka siger, at der er et presserende behov for at udvikle en hurtig, fleksibel, nøjagtigt og realtidsdetektionsværktøj til at klare udfordringen med at beskytte vandforbrugere
Forskere udvikler diagnostisk værktøj til påvisning af cryptosporidiumIngeniørdoktorand George Luka siger, at der er et presserende behov for at udvikle en hurtig, fleksibel, nøjagtigt og realtidsdetektionsværktøj til at klare udfordringen med at beskytte vandforbrugere -
 Forskere afslører metode til at omdanne metangas til flydende methanolOmdannelsen fandt sted under omgivende temperatur- og trykforhold, hvilket kunne gøre det muligt at bruge metan, en potent drivhusgas, til at producere brændstof. Kredit:UFSCAR Det er lykkedes en g
Forskere afslører metode til at omdanne metangas til flydende methanolOmdannelsen fandt sted under omgivende temperatur- og trykforhold, hvilket kunne gøre det muligt at bruge metan, en potent drivhusgas, til at producere brændstof. Kredit:UFSCAR Det er lykkedes en g -
 Undersøgelse undersøger oxidvækst i additivt fremstillede metaller i et superkritisk kuldioxidmil…Kredit:CC0 Public Domain En ny fælles undersøgelse fra Southwest Research Institute og Sandia National Laboratories undersøger forskellene i oxidfilmvækst på additivt fremstillede (AM) metaller og
Undersøgelse undersøger oxidvækst i additivt fremstillede metaller i et superkritisk kuldioxidmil…Kredit:CC0 Public Domain En ny fælles undersøgelse fra Southwest Research Institute og Sandia National Laboratories undersøger forskellene i oxidfilmvækst på additivt fremstillede (AM) metaller og


