Hvorfor er metangas og methanol flydende?
- Den har svage intermolekylære kræfter (van der Waals-kræfter) mellem sine molekyler.
- Molekylerne er små og lette.
- Molekylernes kinetiske energi er høj nok til at overvinde de intermolekylære kræfter og holde molekylerne i bevægelse frit.
Methanol er en væske ved stuetemperatur og -tryk, fordi:
- Det har stærkere intermolekylære kræfter (hydrogenbinding) mellem sine molekyler.
- Molekylerne er større og tungere.
- Molekylernes kinetiske energi er ikke høj nok til at overvinde de intermolekylære kræfter og holde molekylerne i bevægelse frit.
Generelt gælder det, at jo stærkere intermolekylære kræfter mellem molekyler er, jo højere er stoffets kogepunkt. Jo større og tungere molekylerne er, jo højere er kogepunktet. Og jo højere kinetisk energi af molekylerne er, jo lavere kogepunkt.
Sidste artikelHvilke elementer er der i KMnO4?
Næste artikelHvad bruges natriumcitrat til i drikkevarer?
 Varme artikler
Varme artikler
-
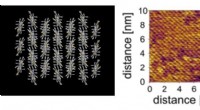 Cellemembran inspirerer til ny ultratynd elektronisk filmSet ovenfra af 3D-computermodel (venstre) og Atomic Force Microscopy-billede (højre) af den nye film lavet af videnskabsmænd fra University of Tokyo. Molekylernes velorganiserede struktur er synlig i
Cellemembran inspirerer til ny ultratynd elektronisk filmSet ovenfra af 3D-computermodel (venstre) og Atomic Force Microscopy-billede (højre) af den nye film lavet af videnskabsmænd fra University of Tokyo. Molekylernes velorganiserede struktur er synlig i -
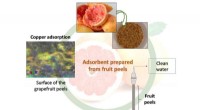 Spildevand renset takket være et nyt adsorberende materiale fremstillet af frugtskallerDiagram over processen designet af UGR-forskerne. Kredit:University of Granada Et samarbejde mellem forskere har udviklet en proces til at rense vand indeholdende tungmetaller og organiske foruren
Spildevand renset takket være et nyt adsorberende materiale fremstillet af frugtskallerDiagram over processen designet af UGR-forskerne. Kredit:University of Granada Et samarbejde mellem forskere har udviklet en proces til at rense vand indeholdende tungmetaller og organiske foruren -
 Ny polymerejendom kan øge tilgængelig solenergiOrganiske solceller er lette som et vindue, der klæber sig fast og kan kopieres som en avis, og dukker op som en levedygtig løsning for landets voksende energibehov. Forskere ved Beckman Institute for
Ny polymerejendom kan øge tilgængelig solenergiOrganiske solceller er lette som et vindue, der klæber sig fast og kan kopieres som en avis, og dukker op som en levedygtig løsning for landets voksende energibehov. Forskere ved Beckman Institute for -
 Smart løsning til at opdage fordærvelse af skaldyrKredit:CC0 Public Domain Vigtigt, Flinders Universitys professor i akvakultur Jian Qin - der ledede undersøgelsen sammen med Flinders kollega professor Youhong Tang - siger, at denne enkle enhed k
Smart løsning til at opdage fordærvelse af skaldyrKredit:CC0 Public Domain Vigtigt, Flinders Universitys professor i akvakultur Jian Qin - der ledede undersøgelsen sammen med Flinders kollega professor Youhong Tang - siger, at denne enkle enhed k
- Skotland valgt som stedet for den første britiske rumhavn
- En kugle rejser med 3000 FPS. Hvis målet er 7500 fod væk, hvor langt er faldet fra sigtelinjen?
- Hvorfor er beholderne, der bruges til at lave mad, normalt lavet af metaller?
- Astronauter ankommer til NASAs første hjemmelancering i årti
- Der er brug for en ny måde at tænke balance mellem arbejde og privatliv på
- Infrarøde spektre af stærkt positivt ladede C60 fullerener og deres relevans for uidentificeret in…


