Hvordan fremstilles ammoniumnitrat industrielt?
1. Ammoniakproduktion:
- Nitrogengas (N2) og brintgas (H2) udvindes fra naturgas.
- Gasserne komprimeres til høje tryk og føres over en katalysator, normalt en blanding af jernoxid og andre metaller, for at fremme reaktionen.
- Denne proces er kendt som Haber-processen, og den producerer ammoniak (NH3).
2. Salpetersyreproduktion:
- Ammoniak oxideres til dannelse af nitrogenoxid (NO) ved at reagere det med oxygen (O2) i nærværelse af en platin- eller rhodiumkatalysator.
- Nitrogenoxidet omsættes derefter med ilt og vand til dannelse af nitrogendioxid (NO2) og salpetersyre (HNO3).
3. Neutralisering og krystallisation:
- Ammoniak bobles ind i koncentreret salpetersyre for at neutralisere det og danne ammoniumnitrat.
- Opløsningen opvarmes derefter og inddampes for at koncentrere den.
- Når opløsningen afkøles, begynder der at dannes ammoniumnitratkrystaller.
4. Filtrering og tørring:
- Ammoniumnitratkrystallerne adskilles fra væsken ved filtrering.
- Krystallerne tørres derefter i en roterende tromletørrer eller en fluid bed-tørrer for at fjerne eventuel resterende fugt.
5. Emballage og opbevaring:
- Tørret ammoniumnitrat er typisk pakket i poser eller bulkcontainere til opbevaring og transport. Det er vigtigt at opbevare ammoniumnitrat korrekt for at undgå utilsigtet detonation.
Bemærk:
- Ammoniumnitrat er et hygroskopisk stof, hvilket betyder, at det absorberer fugt fra luften. Derfor er det afgørende at opbevare det i et tørt miljø for at forhindre sammenklumpning og nedbrydning.
- Urenheder og kontaminanter kan også påvirke stabiliteten af ammoniumnitrat, så strenge kvalitetskontrolforanstaltninger følges under produktion og håndtering.
Sidste artikelHvilket grundstof er i borfamilien og rigelig metalskorpe?
Næste artikelHvordan forankrer nitrogenatomer proteinmolekyler?
 Varme artikler
Varme artikler
-
 Forskere laver syntetiske polymerer inde i levende cellerKredit:CC0 Public Domain Et team af forskere ved University of Edinburgh har vist, at det er muligt at skabe syntetiske polymerer inde i levende celler. I deres papir offentliggjort i tidsskriftet
Forskere laver syntetiske polymerer inde i levende cellerKredit:CC0 Public Domain Et team af forskere ved University of Edinburgh har vist, at det er muligt at skabe syntetiske polymerer inde i levende celler. I deres papir offentliggjort i tidsskriftet -
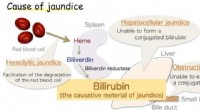 Forskere får gennembrud i antioxidantenzym forbundet med gulsotFig.1:Årsag til gulsot. Bilirubin er det forårsagende materiale til gulsot. Kredit:Osaka University Et japansk forskerhold involveret Osaka University undersøgte biliverdin reduktase, enzymet, der
Forskere får gennembrud i antioxidantenzym forbundet med gulsotFig.1:Årsag til gulsot. Bilirubin er det forårsagende materiale til gulsot. Kredit:Osaka University Et japansk forskerhold involveret Osaka University undersøgte biliverdin reduktase, enzymet, der -
 Dæmpning af havplastikKredit:CC0 Public Domain Efterhånden som mennesker i udviklingslandene bliver mere velhavende, de ender med at købe mere plastik. Men disse områder har ofte ikke gode affaldshåndteringsprocedurer
Dæmpning af havplastikKredit:CC0 Public Domain Efterhånden som mennesker i udviklingslandene bliver mere velhavende, de ender med at købe mere plastik. Men disse områder har ofte ikke gode affaldshåndteringsprocedurer -
 Blomsterlignende nanostrukturer i natriumbatterierNatrium-ion-batterier (SIB) er varme kandidater til en billig og bæredygtig batteriteknologi, men et tilbagevendende problem er anode-ustabilitet. Et kinesisk hold af videnskabsmænd rapporterer nu om
Blomsterlignende nanostrukturer i natriumbatterierNatrium-ion-batterier (SIB) er varme kandidater til en billig og bæredygtig batteriteknologi, men et tilbagevendende problem er anode-ustabilitet. Et kinesisk hold af videnskabsmænd rapporterer nu om
- Sådan fortæller du det negative på et elektrisk apparatsnor
- Påvisning af cyanideksponering
- At ofre californisk udslip kan undgå nødudgivelser
- Næste op er lanceringen, da Boeings Starliner tager turen til Cape Canaveral
- Forskere udvikler ny teknik til at identificere forfalsket flashhukommelse
- Satnav holder øje med rugbyspillere


