Klor kan findes som en ion med en 1-ladning Hvordan sker det?
1. Reaktion med metaller :Når klorgas kommer i kontakt med visse metaller, såsom natrium, overfører metalatomerne deres yderste elektron til kloratomer. Dette resulterer i dannelsen af positivt ladede metalioner (f.eks. $Na^+$) og negativt ladede chloridioner ($Cl^-$). For eksempel:
$$2Na + Cl_2 → 2NaCl$$
I denne reaktion får hvert chloratom en elektron fra natrium og bliver til en chloridion.
2. Reaktion med hydrogen :Klorgas kan også reagere med brintgas ($H_2$) for at producere hydrogenchloridgas ($HCl$). Under denne reaktion får hvert chloratom en elektron fra et brintatom og danner en chloridion. Den overordnede reaktion er:
$$H_2 + Cl_2 → 2HCl$$
3. Reaktion med andre reduktionsmidler :Klorgas kan undergå reduktionsreaktioner med forskellige reduktionsmidler, såsom sulfitter ($SO_3^{2-}$), thiosulfater ($S_2O_3^{2-}$) eller metalhydrider (f.eks. natriumborhydrid, $NaBH_4$ ), hvilket fører til dannelsen af chloridioner.
I disse reaktioner donerer reduktionsmidlerne elektroner til kloratomer, hvilket får dem til at få en ekstra elektron og bliver til chloridioner.
Overordnet set sker dannelsen af chloridioner med en 1-ladning, når chloratomer accepterer en elektron fra et andet atom eller molekyle, hvilket reducerer deres neutrale tilstand til en negativt ladet tilstand.
Sidste artikelHvad er forskellen mellem klorion og atom?
Næste artikelHvilken ladning er klor?
 Varme artikler
Varme artikler
-
 Forskere studerer syntetiske proteinburePakning af proteinbyggesten i sfæriske skaller. Kredit:University of Bristol Et tværfagligt team af matematikere, teoretiske fysikere, kemikere og biokemikere fra University of Bristol gik sammen
Forskere studerer syntetiske proteinburePakning af proteinbyggesten i sfæriske skaller. Kredit:University of Bristol Et tværfagligt team af matematikere, teoretiske fysikere, kemikere og biokemikere fra University of Bristol gik sammen -
 Ekstraordinært tykke organiske lysemitterende dioder løser nagende problemerEn test organisk lysemitterende diode (OLED), der inkorporerer tykke lag af hybrid perovskit, udsender grønt lys. Forskere ved Kyushu University designet enheden til at have tykke lag af perovskit omk
Ekstraordinært tykke organiske lysemitterende dioder løser nagende problemerEn test organisk lysemitterende diode (OLED), der inkorporerer tykke lag af hybrid perovskit, udsender grønt lys. Forskere ved Kyushu University designet enheden til at have tykke lag af perovskit omk -
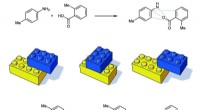 Et kort over reaktioner hjælper med at kontrollere molekylære egenskaberKredit:University of Michigan Kemiske reaktioner bruges til at producere alle slags vigtige molekyler såsom lægemidler, landbrugskemikalier og materialer. At skabe et lægemiddel med specifikke eg
Et kort over reaktioner hjælper med at kontrollere molekylære egenskaberKredit:University of Michigan Kemiske reaktioner bruges til at producere alle slags vigtige molekyler såsom lægemidler, landbrugskemikalier og materialer. At skabe et lægemiddel med specifikke eg -
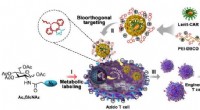 Forskere udvikler kunstige kemiske receptorer til at hjælpe viral transduktion til T-celleteknikAnvendelse af kunstig kemisk receptor i CAR-konstrueret T-cellefremstilling og immunterapi af tumor. Kredit:CAI Lintao Konstrueret T-celle immunterapi, såsom kimærisk antigenreceptor T-celle (CAR-
Forskere udvikler kunstige kemiske receptorer til at hjælpe viral transduktion til T-celleteknikAnvendelse af kunstig kemisk receptor i CAR-konstrueret T-cellefremstilling og immunterapi af tumor. Kredit:CAI Lintao Konstrueret T-celle immunterapi, såsom kimærisk antigenreceptor T-celle (CAR-
- Bevarelse af fortiden i 3D
- Planter, der har egenskaber for blæk
- Forskere finder brede konsekvenser af politisk polarisering
- Tesla -aktier falder efter 3Q -leverancer savner estimater
- Jordskred udløst af orkanen Maria
- Tegnsætning i tekstbeskeder hjælper med at erstatte stikord, der findes i ansigt-til-ansigt-samtal…


