Hvorfor frigiver natriumacetat varme?
Her er en mere detaljeret forklaring af processen:
1. Ionisk dissociation: Når natriumacetat (CH3COONa) opløses i vand, opløses det i natriumioner (Na+) og acetationer (CH3COO-). Denne proces er drevet af polariteten af vandmolekyler, som har en svag positiv ladning ved brintatomerne og en lille negativ ladning ved oxygenatomet. Den positive ladning af vandmolekylerne tiltrækker den negative ladning af acetationerne, hvilket fører til deres adskillelse fra natriumionerne.
2. Hydrogenbindingsdannelse: Acetat-ionerne er polære molekyler, hvor oxygenatomerne bærer en delvis negativ ladning, og hydrogenatomerne bærer en delvis positiv ladning. Denne polaritet gør det muligt for acetat-ionerne at danne hydrogenbindinger med vandmolekylerne. De positive brintatomer i vandmolekylerne tiltrækkes af de negative oxygenatomer i acetationerne og danner stærke intermolekylære bindinger.
3. Energifrigivelse: Dannelsen af brintbindinger mellem acetat-ionerne og vandmolekylerne frigiver energi i form af varme. Denne energifrigivelse skyldes, at hydrogenbindingerne er stærkere end de elektrostatiske tiltrækninger mellem natrium- og acetat-ionerne i det faste natriumacetat. Brydningen af ionbindingerne i natriumacetat kræver energi, men dannelsen af brintbindinger frigiver mere energi, hvilket resulterer i en nettofrigivelse af varme.
Varmen frigivet af natriumacetat ved opløsning i vand er almindeligt observeret i forskellige applikationer, såsom håndvarmere og varmepakker. Disse produkter indeholder en blanding af natriumacetat og vand. Når den aktiveres, gennemgår blandingen en kemisk reaktion, der frigiver varme og giver varme i en periode.
Sammenfattende skyldes frigivelsen af varme, når natriumacetat opløses i vand, primært dannelsen af hydrogenbindinger mellem acetationerne og vandmolekylerne. Hydrogenbindingerne giver stærkere interaktioner sammenlignet med ionbindingerne i natriumacetat, hvilket resulterer i en nettofrigivelse af energi som varme.
Sidste artikelHvad er navnet på sammensat platin?
Næste artikelEr ferrocyanid og ammonium mineraler?
 Varme artikler
Varme artikler
-
 Kemiundervisning går onlineKredit:CC0 Public Domain Med gymnasier og universiteter rundt om i verden lukket på grund af COVID-19-pandemien, kemilærere navigerer skiftet til online læring. Der er flere faktorer, der skal ove
Kemiundervisning går onlineKredit:CC0 Public Domain Med gymnasier og universiteter rundt om i verden lukket på grund af COVID-19-pandemien, kemilærere navigerer skiftet til online læring. Der er flere faktorer, der skal ove -
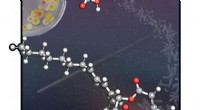 En molekylær trojansk hestDe wienske videnskabsmænd ledet af Maulide udviklede en metode, der anvender en 4-leddet ringprecursor til hurtigt at samle makrocyklussen af de naturlige produkter. Kredit:Giovanni Di Mauro/Maulide
En molekylær trojansk hestDe wienske videnskabsmænd ledet af Maulide udviklede en metode, der anvender en 4-leddet ringprecursor til hurtigt at samle makrocyklussen af de naturlige produkter. Kredit:Giovanni Di Mauro/Maulide -
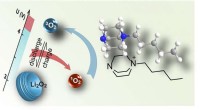 Batteriforskning:nye gennembrud inden for forskning i superbatterierDannelsen af singlet oxygen (1O2) forringer cyklusstabiliteten af mange alkalimetalkatoder, såsom Li-O2 katoden. I tidsskriftet præsenterer Angewandte Chemie Freunberger en effektiv og højspænding
Batteriforskning:nye gennembrud inden for forskning i superbatterierDannelsen af singlet oxygen (1O2) forringer cyklusstabiliteten af mange alkalimetalkatoder, såsom Li-O2 katoden. I tidsskriftet præsenterer Angewandte Chemie Freunberger en effektiv og højspænding -
 Molekyle angriber coronavirus på en ny mådeI forgrunden, aptamerens sekundære struktur. I baggrunden ses den automatiserede SELEX -platform ved LIMES Institute ved University of Bonn. Kredit:Stefan Breuers/LIMES Forskere ved universitetet
Molekyle angriber coronavirus på en ny mådeI forgrunden, aptamerens sekundære struktur. I baggrunden ses den automatiserede SELEX -platform ved LIMES Institute ved University of Bonn. Kredit:Stefan Breuers/LIMES Forskere ved universitetet
- Hvad er den balancerede ligning for redoxreaktion mellem kobber og svovlsyre, der danner kobber(ll)s…
- Lær af månens lys
- Spøgelsespartikel ML-model tillader fuld kvantebeskrivelse af den solvatiserede elektron
- Æble, Broadcom dømt til at betale 1,1 mia. USD for patentkrænkelse
- Parker Solar Probe sporer solvinden til sin kilde på solens overflade:koronale huller
- Hvorfor forsker du?


