Hvor mange mol HCl forbruges i en reaktion 25 mL 4 M tilsættes til overskydende CaCO3?
$$2HCl + CaCO_3 \højrepil CaCl_2 + CO_2 + H_2O$$
Ud fra ligningen kan vi se, at der kræves 2 mol HCl for at reagere med 1 mol CaCO3.
For at beregne antallet af forbrugte mol HCl skal vi først beregne antallet af mol CaCO3, der er til stede i de 25 ml 4 M opløsning.
Antallet af mol CaCO3 i 25 ml 4 M opløsning er:
$$Moles =Koncentration \time Volume$$
$$Moler =4 M \ gange 25 ml =0,1 mol$$
Da der kræves 2 mol HCl for at reagere med 1 mol CaCO3, er antallet af forbrugte mol HCl:
$$Moler =2 \ gange 0,1 mol =0,2 mol$$
Derfor forbruges 0,2 mol HCl i reaktionen.
Sidste artikelHvorfor har gas tryk?
Næste artikelHvordan er gips og selenit kemisk ens?
 Varme artikler
Varme artikler
-
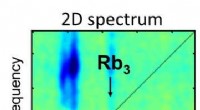 Forskere anvender 2-D spektroskopi til isolerede molekylære systemer for første gang2-D spektroskopi illustrerer de lysinducerede reaktioner af Rubidium molekyler i forskellige farvespektre. Illustration:Lukas Bruder Et forskerhold ledet af Prof. Dr. Frank Stienkemeier og Dr. Luk
Forskere anvender 2-D spektroskopi til isolerede molekylære systemer for første gang2-D spektroskopi illustrerer de lysinducerede reaktioner af Rubidium molekyler i forskellige farvespektre. Illustration:Lukas Bruder Et forskerhold ledet af Prof. Dr. Frank Stienkemeier og Dr. Luk -
 Låser op for mysteriet med katalysatorerPlatin er tidligere blevet brugt til katalyseopgaver, men det er dyrt, hovedsagelig på grund af dens knaphed og også på grund af den minedrift, der kræves for at få den. Platinkatalyse kan også give u
Låser op for mysteriet med katalysatorerPlatin er tidligere blevet brugt til katalyseopgaver, men det er dyrt, hovedsagelig på grund af dens knaphed og også på grund af den minedrift, der kræves for at få den. Platinkatalyse kan også give u -
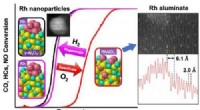 Fremtidige katalysatorer kan give mere valuta for pengeneGrafisk abstrakt. Kredit:Kemi af materialer (2022). DOI:10.1021/acs.chemmater.1c03513 Den næste generation af katalysatorer kan have længere levetid og har brug for færre sjældne materialer for at
Fremtidige katalysatorer kan give mere valuta for pengeneGrafisk abstrakt. Kredit:Kemi af materialer (2022). DOI:10.1021/acs.chemmater.1c03513 Den næste generation af katalysatorer kan have længere levetid og har brug for færre sjældne materialer for at -
 Nyt krystallinsk oxid kan løse problemet med overophedning i kompositmaterialerKredit:Toshihiro Isobe, Tokyo Institute of Technology Forskere ved Tokyo Institute of Technology har for nylig syntetiseret et nyt materiale, der viser unikke termiske ekspansionsegenskaber. Metod
Nyt krystallinsk oxid kan løse problemet med overophedning i kompositmaterialerKredit:Toshihiro Isobe, Tokyo Institute of Technology Forskere ved Tokyo Institute of Technology har for nylig syntetiseret et nyt materiale, der viser unikke termiske ekspansionsegenskaber. Metod
- Sådan fungerer bæredygtigt landbrug
- Tak, Statistikker! En hurtigere måde at forbedre mobilapps på
- Præsident Trumps Nye Det Hvide Hus Klimapanel Indeholder en Klima Denialist
- Fremskridt af forårsvarmen kan forstyrre artsvandring, udvikling
- Dekorerede nanopartikler forhindrer anafylaksi uden at forårsage bivirkninger i museundersøgelse
- NASA og JAXA XRISM opdager jernfingeraftryk i en aktiv galakse i nærheden


