Hvorfor har en chloridion større radius end chloratomet?
Et kloratom har 17 elektroner, hvor den yderste elektron optager en 3p underskal. Derimod har en chloridion fået en ekstra elektron, hvilket resulterer i 18 elektroner. Denne ekstra elektron optager 3p subshell, hvilket gør den fuldstændig fyldt.
De yderste elektroner i et atom eller ion er kendt som valenselektroner, og de har væsentlig indflydelse på atomets størrelse. Valenselektroner er placeret i orbitaler, som er områder omkring kernen, hvor sandsynligheden for at finde en elektron er stor.
Når et atom får en elektron til at blive en ion, øges den elektrostatiske frastødning mellem de negativt ladede elektroner. Denne frastødning får elektronorbitalerne til at udvide sig og bevæge sig længere væk fra kernen. Som et resultat øges den samlede radius af ionen sammenlignet med det neutrale atom.
I tilfældet med chloridionen optager den yderligere elektron 3p-underskallen, som allerede er fyldt med det neutrale kloratom. Den øgede elektron-elektron frastødning i den fyldte 3p subshell får de yderste elektroner til at bevæge sig længere væk fra kernen, hvilket resulterer i den større radius af chloridionen sammenlignet med chloratomet.
Derfor har chloridionen en større radius end chloratomet på grund af det øgede antal elektroner og den resulterende udvidelse af elektronorbitalerne.
Sidste artikelIllustrerer formlen for kaliumiodid oktetreglen?
Næste artikelHvad er den empiriske formel for forbindelse X39Y13?
 Varme artikler
Varme artikler
-
 Automatisering af molekyledesign for at fremskynde lægemiddeludviklingMIT-forskere har udviklet en maskinlæringsmodel, der bedre udvælger molekylekandidater til terapi, samtidig med at det giver mulighed for automatiseret modifikation af den molekylære struktur for høje
Automatisering af molekyledesign for at fremskynde lægemiddeludviklingMIT-forskere har udviklet en maskinlæringsmodel, der bedre udvælger molekylekandidater til terapi, samtidig med at det giver mulighed for automatiseret modifikation af den molekylære struktur for høje -
 Mangan gør sit præg i stofsynteseMangan er overlegen i forhold til sølv og cerium som en måde at fremstille byggesten til lægemiddeldesign og fremstilling, ifølge forskere fra Rice University. Kredit:Yen-Chu Lu/West Laboratory Ba
Mangan gør sit præg i stofsynteseMangan er overlegen i forhold til sølv og cerium som en måde at fremstille byggesten til lægemiddeldesign og fremstilling, ifølge forskere fra Rice University. Kredit:Yen-Chu Lu/West Laboratory Ba -
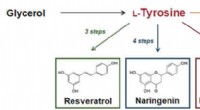 Tyrosin-chassis til bæredygtig, højtydende produktion af nyttige forbindelser i smarte gærcellerFigur 1:Betaxanthin-biosyntesevejen og nyttige forbindelser, der kan syntetiseres ud fra tyrosin. Kredit:Kobe University Kobe University-forskere har med succes udviklet et tyrosin-chassis (en stam
Tyrosin-chassis til bæredygtig, højtydende produktion af nyttige forbindelser i smarte gærcellerFigur 1:Betaxanthin-biosyntesevejen og nyttige forbindelser, der kan syntetiseres ud fra tyrosin. Kredit:Kobe University Kobe University-forskere har med succes udviklet et tyrosin-chassis (en stam -
 Kvantekemi løser mysteriet med de 20 aminosyrer i den genetiske kodeDe første 13 aminosyrer er karakteriseret ved meget ens kemisk hårdhed og elektroniske energiniveauer (vist på billedet som en enkelt cirkel). De nye aminosyrer blev mere og mere blødere og mere indiv
Kvantekemi løser mysteriet med de 20 aminosyrer i den genetiske kodeDe første 13 aminosyrer er karakteriseret ved meget ens kemisk hårdhed og elektroniske energiniveauer (vist på billedet som en enkelt cirkel). De nye aminosyrer blev mere og mere blødere og mere indiv
- Vulkanaskepåvirkning på flyrejser kan reduceres:forskning
- Undersøgelse finder sammenhæng mellem lærernes økonomiske angst og jobpræstation
- Faktorer, der påvirker RF-værdier i tyndtlagskromatografi
- En ny model introducerer begrebet adaptive virtuelle organismer (VO'er)
- To typer af cilia i et paramecium
- Den australske turismepolitik klarer ikke klimaændringer


