Hvad er opløselighedsproduktet af blychlorid?
Opløselighedsproduktet er et mål for en forbindelses opløselighed i vand. Det er defineret som produktet af koncentrationerne af de ioner, der udgør forbindelsen, hver hævet til styrken af dens støkiometriske koefficient i den afbalancerede kemiske ligning for opløsningsreaktionen.
For blychlorid er opløsningsreaktionen:
PbCl2(s) <=> Pb2+(aq) + 2Cl-(aq)
Opløselighedsproduktudtrykket for blychlorid er:
Ksp =[Pb2+][Cl-]^2
hvor Ksp er opløselighedsproduktet, [Pb2+] er koncentrationen af blyioner i mol/L, og [Cl-] er koncentrationen af chloridioner i mol/L.
Ved ligevægt er koncentrationerne af blyioner og chloridioner i en mættet opløsning af blychlorid ens, så vi kan erstatte [Pb2+] med [Cl-] i opløselighedsproduktudtrykket:
Ksp =[Pb2+]^3
Ved at løse for [Pb2+], får vi:
[Pb2+] =(Ksp)^(1/3) =(1,2 * 10^-5)^(1/3) =1,08 * 10^-2 mol/L
Derfor er opløseligheden af blychlorid i vand ved 25°C 1,08 * 10^-2 mol/L.
Sidste artikelHvordan adskiller destillation komponenterne i en blanding?
Næste artikelEr svovl mere reaktivt end fosfor?
 Varme artikler
Varme artikler
-
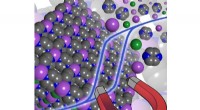 Mod næste generation af molekyle-baserede magneterBilledgengivelse af den molekylebaserede magnet og dens magnetiske egenskaber. Kredit:Rodolphe Clérac Magneter anvendes i en række teknologiske applikationer, inklusive satellitter, telefoner og k
Mod næste generation af molekyle-baserede magneterBilledgengivelse af den molekylebaserede magnet og dens magnetiske egenskaber. Kredit:Rodolphe Clérac Magneter anvendes i en række teknologiske applikationer, inklusive satellitter, telefoner og k -
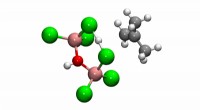 Computerkatalysatorer - team låser molekylære hemmeligheder op for en populær polymerReaktionsmekanisme, der viser en protonoverførsel fra supersyrekatalysatoren til isobutylen. Dette er det første trin i PIB -polymerisationsprocessen. Kredit:Minh Nguyen Vo/Johnson Research Group
Computerkatalysatorer - team låser molekylære hemmeligheder op for en populær polymerReaktionsmekanisme, der viser en protonoverførsel fra supersyrekatalysatoren til isobutylen. Dette er det første trin i PIB -polymerisationsprocessen. Kredit:Minh Nguyen Vo/Johnson Research Group -
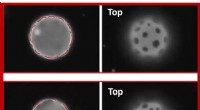 Forskerhold opdager brugen af elasticitet til at placere mikroplader på buede 2D-væskerArrangementer af sortpladelignende domæner, der afhænger af membrankrumning. Kredit:Weiyue Xin fra Santore lab. Et hold af polymervidenskabs- og ingeniørforskere ved University of Massachusetts Am
Forskerhold opdager brugen af elasticitet til at placere mikroplader på buede 2D-væskerArrangementer af sortpladelignende domæner, der afhænger af membrankrumning. Kredit:Weiyue Xin fra Santore lab. Et hold af polymervidenskabs- og ingeniørforskere ved University of Massachusetts Am -
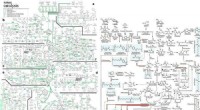 Et omfattende metabolisk kort til produktion af biobaserede kemikalierBiobaseret kemikalieproduktion ad biologiske og kemiske veje. Dette metaboliske kort beskriver repræsentative kemikalier, der kan fremstilles enten ved biologiske og/eller kemiske midler. Røde pile re
Et omfattende metabolisk kort til produktion af biobaserede kemikalierBiobaseret kemikalieproduktion ad biologiske og kemiske veje. Dette metaboliske kort beskriver repræsentative kemikalier, der kan fremstilles enten ved biologiske og/eller kemiske midler. Røde pile re
- Energiforbruget stiger med alderen og temperaturen, viser forskning
- Ulighed:Min uretfærdige ulempe, ikke dit uoptjente privilegium
- Forsker viser global opvarmningseffekt på drivhusgasemissioner i uafskallet jord
- En metode til at reducere antallet af neuroner i tilbagevendende neurale netværk
- Forvrængede meteorregn rammer Jorden i alle vinkler
- Hayabusa2 hjælper forskere med at forstå ingredienser til liv i det tidlige solsystem


