Hvilket grundstof vil helst danne en ionisk forbindelse, når det kombineres med svovl?
Natrium er et meget reaktivt metal, der let mister sin valenselektron for at danne en positivt ladet ion (Na+). Svovl er på den anden side et ikke-metal, der har tendens til at få elektroner for at færdiggøre sin ydre skal. Når disse to grundstoffer kommer sammen, matcher natriums tendens til at tabe elektroner godt med svovls tendens til at få elektroner. Dette resulterer i dannelsen af en ionisk forbindelse, natriumsulfid (Na2S), hvor natriumatomer overfører deres elektroner til svovlatomer, hvilket skaber positivt ladede natriumioner (Na+) og negativt ladede sulfidioner (S2-). Den elektrostatiske tiltrækning mellem disse modsat ladede ioner holder forbindelsen sammen i et ionisk gitter.
 Varme artikler
Varme artikler
-
 Forskere opdager tredimensionel struktur i mindre vanddråberKredit:CC0 Public Domain Vand og dets vekselvirkninger med andre stoffer er afgørende for menneskers liv. Imidlertid, at forstå strukturen af flydende vand og dets hydrogenbindingsnetværk har væ
Forskere opdager tredimensionel struktur i mindre vanddråberKredit:CC0 Public Domain Vand og dets vekselvirkninger med andre stoffer er afgørende for menneskers liv. Imidlertid, at forstå strukturen af flydende vand og dets hydrogenbindingsnetværk har væ -
 Ny beregningsmetode til screening identificerer potentielle faststofelektrolytterKredit:Nationalt Center for Kompetence i Forskning (NCCR) MARVEL Udskiftning af de flygtige og brandfarlige væsker eller polymerelektrolytter, der nu bruges i lithium-ion-batterier, med uorganiske
Ny beregningsmetode til screening identificerer potentielle faststofelektrolytterKredit:Nationalt Center for Kompetence i Forskning (NCCR) MARVEL Udskiftning af de flygtige og brandfarlige væsker eller polymerelektrolytter, der nu bruges i lithium-ion-batterier, med uorganiske -
 Masseproduktion af individualiserede produkterRobot-assisteret inkjet print på 3D overflader hos Fraunhofer ENAS. Kredit:Biermann&Jung Hvordan kan masseproduktionsmetoder anvendes på individualiserede produkter? Et svar er at bruge en kombina
Masseproduktion af individualiserede produkterRobot-assisteret inkjet print på 3D overflader hos Fraunhofer ENAS. Kredit:Biermann&Jung Hvordan kan masseproduktionsmetoder anvendes på individualiserede produkter? Et svar er at bruge en kombina -
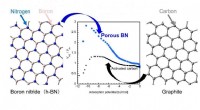 Fange gasser bedre med bornitrid-nanoporerSkematisk illustration af bornitrid- og kulstofstrukturer og adsorptionsevne på porøse bornitrid- og kulstofmaterialer. Kredit:2021 Takahiro Ohkubo Hvad er fælles mellem en teknologi til lagring a
Fange gasser bedre med bornitrid-nanoporerSkematisk illustration af bornitrid- og kulstofstrukturer og adsorptionsevne på porøse bornitrid- og kulstofmaterialer. Kredit:2021 Takahiro Ohkubo Hvad er fælles mellem en teknologi til lagring a
- Dokumenter viser, at Facebook brugte brugerdata som konkurrencevåben (opdatering)
- Er et dyrs smidighed påvirket af dets øjnes position?
- Hvad definerer vi som grønne byområder?
- Hvornår starter den sidste rumfærge i 2011?
- Stigningen i nitrogen har forvandlet sargassum til verdens største skadelige algeopblomstring
- Sådan måles trædensitet


