Hvad gør grundstoffet klor specielt?
1. Høj reaktivitet:
Klor tilhører halogengruppen (Gruppe 17), kendt for sin høje reaktivitet. Det har et atomnummer på 17, hvilket indikerer tilstedeværelsen af syv valenselektroner. Denne elektronkonfiguration gør klor meget elektronegativt, hvilket betyder, at det stærkt tiltrækker elektroner fra andre atomer.
2. Dannelse af klorgas:
Klor eksisterer som en diatomisk gas ved stuetemperatur. Klormolekylerne (Cl2) er sammensat af to kloratomer, der er kovalent bundet sammen. Cl-Cl-bindingen er relativt svag på grund af klors høje elektronegativitet, hvilket resulterer i gassens grøn-gule farve og skarpe lugt.
3. Blegeegenskaber:
En af klorens mest bemærkelsesværdige egenskaber er dens blegende virkning. Det bruges flittigt som blegemiddel på grund af dets stærke oxiderende egenskaber. Når klorgas opløses i vand, danner den hypoklorsyre (HOCl), et kraftigt oxidationsmiddel, der ødelægger pigmenter, der er ansvarlige for farve.
4. Desinfektionsevne:
Klor er bredt anerkendt for dets desinficerende egenskaber. Det er almindeligt anvendt i vandrensning og sanitet til at dræbe mikroorganismer, herunder bakterier, vira og alger. Den oxiderende virkning af klor forstyrrer mikroorganismernes cellemembraner og strukturer, hvilket fører til deres inaktivering.
5. Rolle i menneskelig fysiologi:
I den menneskelige krop spiller kloridioner (Cl-) en afgørende rolle i at opretholde elektrolytbalancen, regulere cellevæskeindholdet og understøtte en korrekt funktion af nerveimpulser og muskelsammentrækninger. Chloridioner er afgørende for at opretholde det generelle helbred og homeostase.
6. Industrielle applikationer:
Klor finder adskillige industrielle anvendelser ud over desinfektion og blegning. Det bruges til fremstilling af polyvinylchlorid (PVC), et alsidigt plastmateriale, der bruges i rør, emballage, byggematerialer og forskellige forbrugerprodukter. Klor er også afgørende i fremstillingen af opløsningsmidler, pesticider og lægemidler.
7. Kemiuddannelse:
Klor har ofte en særlig plads i kemiundervisningen, da det eksemplificerer flere grundlæggende kemiske begreber. Påvisning af klors reaktivitet, blegeegenskaber og gasadfærd giver eleverne uvurderlig indsigt i kemiske reaktioner, binding og tendenserne i det periodiske system.
Sammenfattende gør chlors høje reaktivitet, blegeevne, desinficerende egenskaber, biologiske betydning, industrielle anvendelser og uddannelsesmæssige værdi det til et unikt og alsidigt element, der skiller sig ud blandt de andre elementer i det periodiske system.
Sidste artikelHvad er formlen for forbindelsen mellem cæsium og jod?
Næste artikelAluminiumklorat som en kemisk formel?
 Varme artikler
Varme artikler
-
 En uventet virkemåde for et antistofFor at illustrere den funktionelle mimik opdaget i antistoffer mod SARS-coronavirus, en mime holder i hånden SARS-CoV S bundet til ACE2-receptoren (blågrøn). Hans refleksion viser et SARS-CoV S bundet
En uventet virkemåde for et antistofFor at illustrere den funktionelle mimik opdaget i antistoffer mod SARS-coronavirus, en mime holder i hånden SARS-CoV S bundet til ACE2-receptoren (blågrøn). Hans refleksion viser et SARS-CoV S bundet -
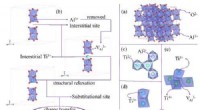 Forskere opdager oprindelsen af næsten ultraviolette og synlige absorptionsegenskaber af Ti:safir…Fig. 1. (a) Supercellestrukturen af Al2O3, (b) det mellemliggende Ti 3 + , Al ledig og substituerende Ti 3 + modeller, og deres transformationsproces, (c) linjekontakten Ti 3 + -Ti 3
Forskere opdager oprindelsen af næsten ultraviolette og synlige absorptionsegenskaber af Ti:safir…Fig. 1. (a) Supercellestrukturen af Al2O3, (b) det mellemliggende Ti 3 + , Al ledig og substituerende Ti 3 + modeller, og deres transformationsproces, (c) linjekontakten Ti 3 + -Ti 3 -
 Nyt materiale med magnetisk formhukommelsePaolo Testa, første forfatter til undersøgelsen, med en model af den overordnede struktur af formhukommelsesmaterialet Kredit:Paul Scherrer Institute/Mahir Dzambegovic Forskere ved Paul Scherrer I
Nyt materiale med magnetisk formhukommelsePaolo Testa, første forfatter til undersøgelsen, med en model af den overordnede struktur af formhukommelsesmaterialet Kredit:Paul Scherrer Institute/Mahir Dzambegovic Forskere ved Paul Scherrer I -
 At belyse, hvordan asymmetri giver kemiske egenskaberKredit:CC0 Public Domain Du har hørt udtrykket form følger funktion? I materialevidenskab, funktion følger form. Ny forskning af Carnegies Olivier Gagné og samarbejdspartner Frank Hawthorne fra U
At belyse, hvordan asymmetri giver kemiske egenskaberKredit:CC0 Public Domain Du har hørt udtrykket form følger funktion? I materialevidenskab, funktion følger form. Ny forskning af Carnegies Olivier Gagné og samarbejdspartner Frank Hawthorne fra U
- Sådan bestemmes en molekyler Polarity
- Sådan reparerer zebrafisken et knust hjerte
- Klimaundersøgelse ser på menneskers eksponering for ekstreme temperaturer i det 21. århundrede
- Hvordan kreditplatforme kan gøre banklånslofter ineffektive
- Bsal og videre:Taskforce hjælper med at afværge truslen om paddesygdomme
- Adressering af sikkerheden ved kombineret eksponering for flere kemikalier for mennesker og miljø


