Sådan reparerer zebrafisken et knust hjerte
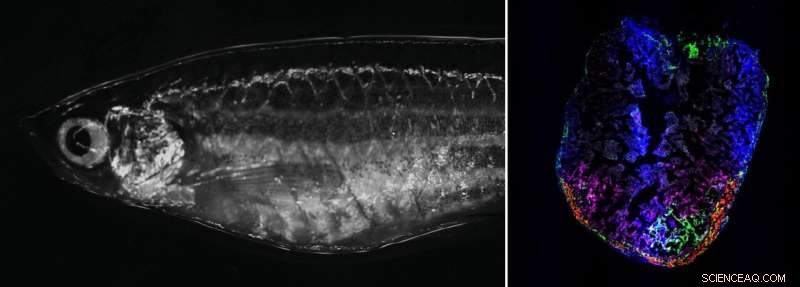
Til højre:Voksen zebrafisk i lysfeltsmikroskopet. Til venstre:Zebrafiskhjerte 7 dage efter kryoskade. Forbigående aktiverede fibroblaster lokaliseres til skadeområdet. Kredit:Panáková Lab, MDC
Et MDC-forskerhold ledet af Jan Philipp Junker og Daniela Panáková har fundet ud af, at zebrafisk kan regenerere hjertevæv efter skade. Bindevævsceller spiller en vigtig rolle i processen ved midlertidigt at gå ind i en aktiveret tilstand, som holdet rapporterer i Nature Genetics .
Når en person får et hjerteanfald og ikke får behandling hurtigt nok, bliver hjertemuskelceller (kardiomyocytter) beskadiget af iltmangel og begynder at dø ud. Så dannes der arvæv, og fordi vi ikke kan producere nye kardiomyocytter, kan hjertet ikke længere pumpe så godt, som det burde. Tingene er meget anderledes hos lavere hvirveldyr som zebrafisken, der kan regenerere organer – inklusive hjertet.
"Vi ville finde ud af, hvordan denne lille fisk gør det, og om vi kunne lære af det," siger professor Jan Philipp Junker, leder af Quantitative Developmental Biology Lab ved Berlin Institute for Medical Systems Biology (BIMSB), en del af Max Delbrück Center for Molekylær Medicin i Helmholtz Association (MDC) i Berlin. I samarbejde med Dr. Daniela Panáková, som leder Elektrokemisk Signalering i Udviklings- og Sygdomslaboratoriet ved MDC, simulerede forskerne myokardieinfarktskader i hjertet af deres zebrafisk. Ved hjælp af enkeltcelleanalyser og celleafstamningstræer sporede de regenereringen af kardiomyocytterne. De har nu offentliggjort deres observationer i tidsskriftet Nature Genetics .
Menneskets hjerter stopper uden regenerering
Forskerne startede med at holde en kold nål til zebrafiskens hjerte på én millimeter i et par sekunder under et mikroskop. Nålen dræber alt væv, den rører ved. Ligesom hos humane hjerteanfaldspatienter forårsager dette en inflammatorisk respons, som efterfølges af ardannelse fra bindevævsceller kendt som fibroblaster. "Overraskende nok er den umiddelbare reaktion på skaden meget ens. Men mens processen hos mennesker stopper på det tidspunkt, fortsætter den i fiskene. De danner nye kardiomyocytter, som er i stand til at trække sig sammen," siger Junker.
"Vi ønskede at identificere de signaler, der kommer fra andre celler og hjælpe med at drive regenereringen," fortsætter han. Junkers team brugte enkeltcellet genomik til at søge i det skadede hjerte for celler, der ikke findes i et sundt zebrafiskhjerte. De fandt tre nye typer fibroblaster, der midlertidigt går ind i en aktiveret tilstand. Selvom de eksternt er identiske med de andre fibroblaster, kan disse aktiverede celler læse en hel række yderligere gener, der er ansvarlige for at danne proteiner – såsom bindevævsfaktorer som kollagen 12.
Fibroblaster giver signalet til regenerering
Hos mennesker ses ardannelse (eller fibrose) som en hindring for at regenerere hjertet. Men fibroblasterne ser ud til at være vigtige for processen, så snart de går ind i deres midlertidigt aktiverede tilstand. Hvor vigtige de er blev tydeligt, da Panáková brugte et genetisk trick til at slukke for de kollagen 12-udtrykkende fibroblaster i zebrafiskene. Resultatet:ingen regenerering. Junker mener, det giver mening, at fibroblaster er ansvarlige for at give reparationssignalerne:"De dannes jo lige på skadestedet," siger han.
For at identificere kilden til disse aktiverede fibroblaster producerede Junkers team celleafstamningstræer ved hjælp af en teknik kaldet LINNAEUS, som hans laboratorium udviklede i 2018. LINNAEUS arbejder med genetiske ar, der tilsammen fungerer som en stregkode for oprindelsen af hver celle. "Vi skaber denne stregkode ved hjælp af CRISPR-Cas9 genetiske saks. Hvis to celler efter skade har den samme stregkodesekvens, betyder det, at de er beslægtede," forklarer Junker. Forskerne identificerede to kilder til midlertidigt aktiverede fibroblaster:det ydre lag af hjertet (epicardium) og det indre lag (endokardium). Celler, der producerer kollagen 12, blev udelukkende fundet i epicardiet.
Forskellige discipliner arbejdede tæt sammen om undersøgelsen
Flere MDC-forskere samarbejdede gennem hele undersøgelsen - fra eksperimenterne på fiskene, til de genetiske analyser, til den bioinformatiske fortolkning af resultaterne. "For mig var det mest spændende at se, hvor godt vores discipliner komplementerer hinanden, og hvordan vi kunne verificere resultater fra bioinformatik på et levende dyr," siger Sara Lelek, der er hovedforfatter af undersøgelsen og var ansvarlig for dyret. tests. "Det var et stort projekt, der gjorde det muligt for os alle at bidrage med vores ekspertise. Jeg tror, det er derfor, undersøgelsen er så omfattende og så nyttig for mange forskere."
Dr. Bastiaan Spanjaard, også hovedforfatter, er enig:"Fordi vi havde så forskellige ekspertiseområder, var vi ofte nødt til at forklare vores eksperimenter og analyser for hinanden. Hjerteregenerering er en kompleks proces, der er påvirket af mange forskellige ting. Eksperimenterne producerede enorme mængder data. At filtrere de korrekte biologiske signaler ud af dem var enormt udfordrende."
Det er stadig uklart, om beskadigede hjerter hos pattedyr som mennesker og mus mangler de nødvendige signaler eller evnen til at læse signalerne. Hvis signalerne mangler, kan der i sidste ende udvikles medicin til at simulere dem. Men, siger Junker, at finde en måde at efterligne signalfortolkning ville være meget sværere.
Fibroblaster hjælper også med at danne nye blodkar
Forskerne vil nu se nærmere på de gener, som de midlertidigt aktiverede fibroblaster læser særligt ofte. De ved, at mange af de pågældende gener er vigtige for at frigive proteiner til det omkringliggende område. Og disse kan omfatte faktorer, der også påvirker kardiomyocytter. Og første bevis tyder på, at de aktiverede fibroblaster ikke kun fremmer regenereringen af hjertet; de er også med til at danne nye blodkar, der forsyner hjertet med ilt.
 Varme artikler
Varme artikler
-
 Hvordan dopamin hjælper med at få nogle madvarer AddictingSynes du det er svært at ignorere sukkerholdige godbidder som kage eller slik? Selvom viljestyrke spiller en rolle, kan du også skylde din hjerne. Visse fødevarer med et højt fedtindhold eller sukkeri
Hvordan dopamin hjælper med at få nogle madvarer AddictingSynes du det er svært at ignorere sukkerholdige godbidder som kage eller slik? Selvom viljestyrke spiller en rolle, kan du også skylde din hjerne. Visse fødevarer med et højt fedtindhold eller sukkeri -
 Undersøgelse advarer om, at slangesvampesygdom kan være en global trusselmælkeslange ( Lampropeltis triangulum ) viser tegn på svampe- og bakterieinfektioner. Kredit:© USGS National Wildlife Health Center/D.E. Grøn Ny forskning tyder på, at en potentielt dødelig slan
Undersøgelse advarer om, at slangesvampesygdom kan være en global trusselmælkeslange ( Lampropeltis triangulum ) viser tegn på svampe- og bakterieinfektioner. Kredit:© USGS National Wildlife Health Center/D.E. Grøn Ny forskning tyder på, at en potentielt dødelig slan -
 Protein stopper bevidst egen syntese ved at destabilisere syntesemaskineriet - ribosometRibosomet bliver destabiliseret af proteinet (spirende kæde), det selv syntetiserede (IRD) og splittes fra hinanden i de store og små underenheder. Som resultat, proteinsyntesen slutter midt i cykluss
Protein stopper bevidst egen syntese ved at destabilisere syntesemaskineriet - ribosometRibosomet bliver destabiliseret af proteinet (spirende kæde), det selv syntetiserede (IRD) og splittes fra hinanden i de store og små underenheder. Som resultat, proteinsyntesen slutter midt i cykluss -
 En klasse for sig:Nye faktorer styrer transport af rødalger kloroplastproteinEn særskilt klasse af GTPase, PTF, er involveret i import af chloroplastprotein i Rhodophyta. Kredit:Masato Nakai Havene kaldes ofte Jordens endelige grænse. Nu har forskere fra Japan vist, at det
En klasse for sig:Nye faktorer styrer transport af rødalger kloroplastproteinEn særskilt klasse af GTPase, PTF, er involveret i import af chloroplastprotein i Rhodophyta. Kredit:Masato Nakai Havene kaldes ofte Jordens endelige grænse. Nu har forskere fra Japan vist, at det
- Astronomer finder beviser for den mest kraftfulde pulsar i en fjern galakse
- NASA satellit analyserer den kraftige supertyfon Mangkhut
- Fysikere demonstrerer topologisk superledning på palladiumdibismuthider
- Amerikanske unge ved ikke meget om ungdomsretssystemet
- Orkaner, oversvømmelsesforsikring og farerne ved business as usual
- Metal hvisken:At finde en bedre måde at genvinde ædle metaller fra elektronisk affald


