Protein stopper bevidst egen syntese ved at destabilisere syntesemaskineriet - ribosomet
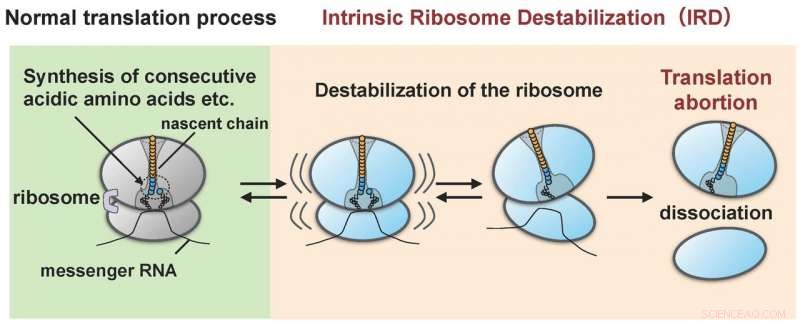
Ribosomet bliver destabiliseret af proteinet (spirende kæde), det selv syntetiserede (IRD) og splittes fra hinanden i de store og små underenheder. Som resultat, proteinsyntesen slutter midt i cyklussen uden at nå slutpunktet. Kredit:Hidekii Taguchi
En fælles forskningsgruppe af Tokyo Institute of Technology (Tokyo Tech) og Kyoto Sangyo University har opdaget, at et protein, under dets syntese, kan destabilisere strukturen af ribosomet og afslutte sin egen syntese for tidligt, og fandt ud af, at dette fænomen bruges til at tilpasse cellen til dens miljø.
Baggrund
Proteiner er funktionelle molekyler, som understøtter liv og er tredimensionelle strukturer af polypeptidkæder, kæder af forbundne aminosyrer. Konfigurationen af aminosyrer på denne kæde (sekvensen) er skrevet i DNA-sekvensen. Polypeptidkæder dannes, hvor ribosomet, proteinsyntesemaskineriet, ligger på en kopi af DNA-sekvensen (budbringer-RNA). Den begynder at polymerisere aminosyrer én efter én ved at vælge blandt 20 typer aminosyrer, der skal tilføjes til linket i henhold til den genetiske kode. Det afsluttes ved endepunktet, hvor kæden løsnes fra ribosomet.
Processen med at et protein syntetiseres ved et ribosom kaldes "oversættelse, "og alle proteiner fra alle levende organismer, inklusive mennesker, produceres gennem oversættelse. Man havde troet, at i processen med at forbinde aminosyrer ved ribosomet, den nydannede polypeptidkæde (spirende kæde) blev syntetiseret kontinuerligt.
I nyere undersøgelser foretaget af denne forskergruppe og andre, det er blevet tydeligt, at hastighedsudsving forekommer betydeligt i oversættelsen - at nogle begyndende kæder, afhængig af aminosyresekvensen, virke på ribosomet, der danner det, for at sænke translationstrintiden.
Oversigt over forskningsresultatet
Forskergruppen ledet af Hideki Taguchi ved Tokyo Tech og Koreaki Ito ved Kyoto Sangyo University fandt, at når et rekonstitueret cellefrit translationssystem af E. coli blev lavet til at oversætte proteiner med sekvenser på omkring ti sure aminosyrer (asparaginsyre og glutaminsyre) eller sekvenser, hvor enten sur aminosyre og en aminosyre kaldet prolin er koblet skiftevis, translation stopper midtvejs, når en sådan sekvens er blevet oversat. Denne mislykkede hændelse opstår, når ribosomerne, der syntetiserer aminosyresekvensen, bliver destabiliserede som et resultat af at blive påvirket af den begyndende kæde (forskerne betegner denne "IRD":"intrinsic ribosom destabilization"). Det resulterer i, at ribosomet opdeles i de store og små underenheder (figur 1). Ribosomet, med sin rolle at syntetisere flere tusinde eller titusindvis af typer proteiner i cellen, var blevet anset for at have kommandoen til at forbinde enhver kombination af aminosyresekvenser. Imidlertid, opdagelsen af IRD, hvor ribosomet destabiliseres under translation af spirende kæder, det selv syntetiserer, indikerer, at oversættelse er noget, der skrider frem med den potentielle risiko for at blive afbrudt. Proteiner, som inkluderer aminosyresekvenser, der udløser IRD, er ikke i stand til at fuldføre deres syntese.
Ved første øjekast, dette fænomen med IRD kan virke som en defekt i ribosomet, men hvad betyder det for levende organismer?
Forskerne havde opdaget, at levende organismer også besidder en mekanisme til at modvirke IRD. Dette fund fik dem til at bruge en mutant af E. coli, der mangler denne mekanisme, med ribosomer således let destabiliserede og tilbøjelige til IRD, og analysere alt proteinet inde i en celle (proteomet). Som resultat, holdet fandt ud af, at i mutanten, de cellulære mængder af en række proteiner varierede sammenlignet med den vilde stamme. I særdeleshed, MgtA, et membranprotein, der transporterer magnesiumioner ind i celler, viste sig at være udtrykt over ti gange mere. Interessant nok, genet kaldet mgtL og regulerer ekspressionen af MgtA besad en IRD-sekvens. Resultatet af analysen viste, at E. coli regulerer ekspressionen af MgtA, ved hjælp af en speciel mekanisme med IRD-fænomenet på grund af sekvensen af mgtL, som reaktion på ændringer i magnesiumkoncentrationerne i cellen.
Magnesiumioner er nødvendige for mange livsprocesser inde i cellen, og er påkrævet til oversættelse, i særdeleshed, for at stabilisere ribosomet. Dermed, resultaterne af denne forskning tyder på, at E. coli har erhvervet en mekanisme til at opretholde den cellulære magnesiumionkoncentration ved at bruge mgtL's IRD-evne til at udtrykke en overflod af MgtA, når dets vækstmiljø bliver fattigt på magnesium. Med andre ord, en levende organisme har en mekanisme til at overvåge ændringer i det intracellulære miljø ved at drage fordel af fænomenet IRD (figur 2).
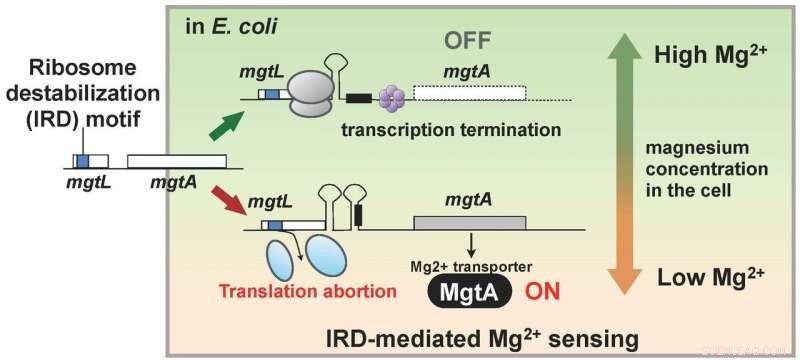
Genet, mgtL, at kontrollere ekspressionen af membranproteinet MgtA, som transporterer magnesium ind i celler, har en ribosom-destabiliserende sekvens, og translation afbrydes, når magnesiumkoncentrationen inde i cellen er lav. Der er en mekanisme, som aktiverer MgtA-syntese, når mgtL-translation afbrydes, og det menes, at den resulterende rigelige ekspression af MgtA hæver magnesiumionkoncentrationen inde i cellen. Kredit:Hideki Taguchi
Fremtidige udviklinger
Denne undersøgelse viste, at ud over at indeholde information, der bestemmer tredimensionelle strukturer af proteiner, aminosyresekvenser har endda evnen til at påvirke stabiliteten af det maskineri, der syntetiserer det, og til at afbryde translation midt i cyklussen, til sidst. Dette fremmer vores forståelse af grundlaget for livsprocesser, som understøttes af reguleret ekspression af genetisk information. Tidlig, for tidligt ophør af oversættelse var hidtil ikke blevet anset for at være en vital proces i biovidenskaberne. Taguchi og teammedlemmerne mener, at deres præstation kan udvides, i forbindelse med den nuværende velstand inden for biovidenskab, til forskellige anvendelser såsom produktion af nye nyttige proteiner eller udvikling af biofarmaceutiske midler.
 Varme artikler
Varme artikler
-
 Hvordan er dyr & planter ens?Når du ser på et familiekæledyr, såsom en hund eller kat, og så ser på en plante, kan det være svært at se nogen ligheder mellem de to. Selvom en hund måske ikke ser ud til at have meget til fælles
Hvordan er dyr & planter ens?Når du ser på et familiekæledyr, såsom en hund eller kat, og så ser på en plante, kan det være svært at se nogen ligheder mellem de to. Selvom en hund måske ikke ser ud til at have meget til fælles -
 Baby næsehorn galopperer til offentligheden i Singapore ZooDa han blev en måned gammel, dyrepasserne besluttede, at det var tid til at introducere Oban til den offentlige indhegning Et baby hvidt næsehorn har gjort sit første indtog i rampelyset, galopper
Baby næsehorn galopperer til offentligheden i Singapore ZooDa han blev en måned gammel, dyrepasserne besluttede, at det var tid til at introducere Oban til den offentlige indhegning Et baby hvidt næsehorn har gjort sit første indtog i rampelyset, galopper -
 Sådan tælles kolonier i mikrobiologiEn af de klassiske måder at bestemme koncentrationen af mikrober i en prøve er at fortynde prøven, dyrke mikroberne på plader og tælle kolonierne. De belagte mikrober vokser fra en kolonidannende en
Sådan tælles kolonier i mikrobiologiEn af de klassiske måder at bestemme koncentrationen af mikrober i en prøve er at fortynde prøven, dyrke mikroberne på plader og tælle kolonierne. De belagte mikrober vokser fra en kolonidannende en -
 Er mistelten mere end blot en undskyldning for et kys?Kredit:Royal Botanic Gardens, Kew Viscum album er en af de bedst kendte parasitplanter - i det væsentlige får både vand og næringsstoffer fra den plante, den har gjort sit hjem. Men dens unikke
Er mistelten mere end blot en undskyldning for et kys?Kredit:Royal Botanic Gardens, Kew Viscum album er en af de bedst kendte parasitplanter - i det væsentlige får både vand og næringsstoffer fra den plante, den har gjort sit hjem. Men dens unikke
- Ny teknik forbereder 2-D perovskit-enkeltkrystaller til højeste fotodetektivitet
- Kameraet giver udsigt til Suns polarområder
- At putte en brændselscelle i lommen
- Graver i Jordens historie:Tager en geologisk historie om Mojave-ørkenen
- Ny T-Mobile annoncerer budgetplan til $15 om måneden og 5G kommer den 6. december
- Fødevarepriser til forbrugere i etniske enklaver kan forklare forskel i assimileringshastigheder


