Hvordan danner klor anioner?
Ioniseringen af klor kan repræsenteres ved følgende ligning:
Cl(g) + e- → Cl-(g)
I denne ligning repræsenterer Cl(g) et chloratom i dets gasformige tilstand, e- repræsenterer en elektron, og Cl-(g) repræsenterer en chloridion i dets gasformige tilstand.
Kloratomer kan få elektroner fra andre atomer eller molekyler for at danne chloridioner. For eksempel, når klorgas opløses i vand, donerer vandmolekylerne elektroner til kloratomerne, hvilket får dem til at blive kloridioner. Denne reaktion kan repræsenteres ved følgende ligning:
Cl2(g) + 2H2O(l) → 2Cl-(aq) + 2H+(aq) + 2OH-(aq)
I denne ligning repræsenterer Cl2(g) chlorgas, H2O(l) repræsenterer flydende vand, Cl-(aq) repræsenterer chloridioner i vandig opløsning, H+(aq) repræsenterer hydrogenioner i vandig opløsning, og OH-(aq) repræsenterer hydroxidioner i vandig opløsning.
Dannelsen af chloridioner er en almindelig kemisk reaktion, der forekommer i mange forskellige miljøer. Chloridioner findes i en lang række forbindelser, herunder natriumchlorid (NaCl), kaliumchlorid (KCl) og calciumchlorid (CaCl2).
Sidste artikelKan man opbevare kobberklorid i en jernbeholder?
Næste artikelHvilken jord dannes ved udvaskning og oxidation?
 Varme artikler
Varme artikler
-
 Forskere observerer ultrahurtig fødsel af radikalerRøntgenstråler fanger den ultrahurtige protonoverførselsreaktion i ioniseret flydende vand, danner hydroxylgruppen (OH) og hydronium-ionen (H3O+). Kredit:Argonne National Laboratory Et internation
Forskere observerer ultrahurtig fødsel af radikalerRøntgenstråler fanger den ultrahurtige protonoverførselsreaktion i ioniseret flydende vand, danner hydroxylgruppen (OH) og hydronium-ionen (H3O+). Kredit:Argonne National Laboratory Et internation -
 Video:Surfside-lejlighedskollaps og videnskaben om betonBetonbygninger falder ikke bare sammen ud af det blå. Selv jordskælv er ikke meningen at bringe dem ned. Så hvorfor byggede Champlain Towers South-bygningen i Surfside, Florida - en moderne struktur b
Video:Surfside-lejlighedskollaps og videnskaben om betonBetonbygninger falder ikke bare sammen ud af det blå. Selv jordskælv er ikke meningen at bringe dem ned. Så hvorfor byggede Champlain Towers South-bygningen i Surfside, Florida - en moderne struktur b -
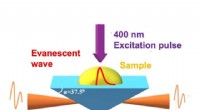 Terahertz-bølger afslører skjulte processer i ultrahurtig kunstig fotosynteseOpsætning til tidsopløst terahertz-dæmpet totalreflektion (TR-ATR) spektroskopi. Kredit:Osaka University Et team af forskere fra Osaka University, i samarbejde med Tokyo Institute of Technology, d
Terahertz-bølger afslører skjulte processer i ultrahurtig kunstig fotosynteseOpsætning til tidsopløst terahertz-dæmpet totalreflektion (TR-ATR) spektroskopi. Kredit:Osaka University Et team af forskere fra Osaka University, i samarbejde med Tokyo Institute of Technology, d -
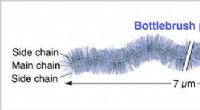 Verdens længste flaskebørstepolymer nogensinde syntetiseretFlaskebørstepolymer er en polymer bestående af en enkelt hovedkæde og adskillige sidekæder podet fra hovedkæden. Kredit:National Institute for Materials Science NIMS og RIKEN er lykkedes med at sy
Verdens længste flaskebørstepolymer nogensinde syntetiseretFlaskebørstepolymer er en polymer bestående af en enkelt hovedkæde og adskillige sidekæder podet fra hovedkæden. Kredit:National Institute for Materials Science NIMS og RIKEN er lykkedes med at sy
- Forskere klar til Cassini-missionen til Saturns store finale
- Sådan fungerer multitasking
- Baidu -overskuddet vokser 56%, når apps og AI øger indtægterne
- Fleksible generatorer gør bevægelse til energi
- En 15-årig sagde, at han opdagede sårbarhed i hardware-tegnebog
- Undersøgelse advarer om, at fattigdommen stiger til over 1 milliard på grund af virus


