Hvorfor er KI en katalysator for H202-nedbrydning, men KBr og KCl
Den katalytiske aktivitet af KI i H2O2-nedbrydning kan tilskrives de specifikke kemiske egenskaber af iodidioner (I-). Her er et par grunde til, at KI er en effektiv katalysator for denne reaktion:
Dannelse af et aktivt kompleks:Når KI sættes til en opløsning af H2O2, gennemgår det en redoxreaktion med H2O2, hvilket fører til dannelsen af et aktivt mellemkompleks. Dette kompleks involverer overførsel af elektroner mellem I- og H2O2, hvilket resulterer i dannelsen af meget reaktive arter, der kan lette nedbrydningen af H2O2.
Kædereaktionsmekanisme:Nedbrydningen af H2O2 i nærvær af KI forløber gennem en kædereaktionsmekanisme. Reaktionen involverer kontinuerlig dannelse og forbrug af frie radikaler, såsom hydroxylradikaler (OH-) og iodradikaler (I.). Disse radikaler reagerer med H2O2, hvilket fører til dannelsen af vand- og iltmolekyler. Den kontinuerlige cyklus af disse radikaler opretholder nedbrydningsprocessen.
Regenerering af aktive arter:I den katalytiske cyklus regenereres iodidionerne (I-), hvilket giver dem mulighed for at deltage i flere cyklusser af reaktionen. Denne regenereringsproces sikrer en kontinuerlig forsyning af aktive arter, hvilket muliggør en vedvarende nedbrydning af H2O2.
I modsætning hertil har KBr og KCl ikke de samme katalytiske egenskaber som KI til H2O2-nedbrydning. Dette skyldes, at bromid (Br-) og chlorid (Cl-) ioner ikke gennemgår de samme redoxreaktioner og ikke danner de aktive mellemkomplekser, der er essentielle for den katalytiske proces. Som et resultat udviser KBr og KCl ikke signifikant katalytisk aktivitet i nedbrydningen af H2O2.
Sammenfattende kan den katalytiske aktivitet af KI i H2O2-nedbrydning tilskrives dannelsen af et aktivt kompleks, involveringen af en kædereaktionsmekanisme og regenereringen af aktive arter. Disse faktorer gør det muligt for KI effektivt at lette nedbrydningen af H2O2 til vand og oxygen, mens KBr og KCl mangler disse katalytiske egenskaber.
 Varme artikler
Varme artikler
-
 Nyt atlas med lipidform er nøglen til tidlig sygdomsdetektionLipidatlasset bygget af Vanderbilt University kemikere kan tilføjes, når andre forskere begynder at afkode molekyleformer. Kredit:The McLean Group Hver en smule information om en persons helbred -
Nyt atlas med lipidform er nøglen til tidlig sygdomsdetektionLipidatlasset bygget af Vanderbilt University kemikere kan tilføjes, når andre forskere begynder at afkode molekyleformer. Kredit:The McLean Group Hver en smule information om en persons helbred - -
 Hvordan tardigradens hemmeligheder kunne forbedre livreddende lægemidler som insulinSEM-billede af Milnesium tardigradum i aktiv tilstand. Kredit:PLoS ONE 7(9):e45682. doi:10.1371/journal.pone.0045682 UCLA-kemiker Heather Maynard måtte undre sig:Hvordan gør organismer som tardigra
Hvordan tardigradens hemmeligheder kunne forbedre livreddende lægemidler som insulinSEM-billede af Milnesium tardigradum i aktiv tilstand. Kredit:PLoS ONE 7(9):e45682. doi:10.1371/journal.pone.0045682 UCLA-kemiker Heather Maynard måtte undre sig:Hvordan gør organismer som tardigra -
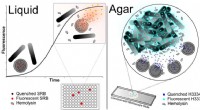 Lipidvesikler erstatter blod i ny bakterietestKredit:American Chemical Society Efterhånden som skoler rundt om i USA starter op igen, det samme gør ture til lægehuset. Men er den rå halsbetændelse på grund af bakterier, som kan bekæmpes med a
Lipidvesikler erstatter blod i ny bakterietestKredit:American Chemical Society Efterhånden som skoler rundt om i USA starter op igen, det samme gør ture til lægehuset. Men er den rå halsbetændelse på grund af bakterier, som kan bekæmpes med a -
 Enzym fra briny dyb genopstod i laboratorietRosetprøveudtageren bruges til at indsamle bakterieprøverne fra saltvandspuljen i Det Røde Hav. Kredit:André Antunes, Edge Hill University, Storbritannien. Mystiske mikrober, der trives i varme og
Enzym fra briny dyb genopstod i laboratorietRosetprøveudtageren bruges til at indsamle bakterieprøverne fra saltvandspuljen i Det Røde Hav. Kredit:André Antunes, Edge Hill University, Storbritannien. Mystiske mikrober, der trives i varme og
- Oversvømmelser og orkaner forudsagt med sociale medier
- Afkodning af de grundlæggende mekanismer for menneskelig spytsmøring
- Overvågning af luftkvaliteten på Hawaiis Big Island under Kilauea-udbruddet
- Sådan beregnes volumen på et atom
- Uddybning af datasøen
- Hvad er funktionerne ved kulhydratanhydrase?


