Hvad er definitionen for flydende fast stof og gas?
solid
* Definition: En tilstand af stof, der er kendetegnet ved en fast form og volumen.
* Nøgleegenskaber:
* stiv struktur: Partikler er tæt pakket sammen i et almindeligt, gentagende mønster.
* Stærke intermolekylære kræfter: Disse kræfter holder partikler tæt på plads og modstår ændringer i form og volumen.
* Lav kompressibilitet: Faststoffer er vanskelige at komprimere på grund af den tætte pakning af partikler.
* bestemt form og volumen: Opretholder sin egen form og optager en bestemt mængde plads.
Eksempler: Is, træ, klippe, metal
væske
* Definition: En tilstand af stof, der er kendetegnet ved et fast volumen, men en variabel form.
* Nøgleegenskaber:
* mindre stiv struktur: Partikler er tæt sammen, men kan bevæge sig mere frit end i et fast stof.
* Moderat intermolekylære kræfter: Kræfterne er svagere end i et solidt, hvilket giver mulighed for fluiditet.
* Moderat kompressibilitet: Væsker kan komprimeres i lille grad.
* bestemt volumen, ubestemt form: Tager formen på sin beholder.
Eksempler: Vand, olie, kviksølv, honning
gas
* Definition: En tilstand af stof, der er kendetegnet ved hverken en fast form eller et fast volumen.
* Nøgleegenskaber:
* meget svage intermolekylære kræfter: Partikler er langt fra hinanden og bevæger sig frit.
* Høj kompressibilitet: Gasser kan let komprimeres, fordi partikler ikke holdes tæt på hinanden.
* ubestemt form og volumen: Tager formen og volumenet på dens beholder.
* Høj diffusionshastighed: Partikler spredte sig hurtigt gennem deres beholder.
Eksempler: Luft, ilt, kuldioxid, helium
Nøgleforskelle
Den største forskel mellem disse tilstande af stof ligger i arrangementet og bevægelsen af deres partikler:
* faste stoffer: Partikler er tæt pakket og vibrerer på plads.
* væsker: Partikler er tæt sammen, men kan bevæge sig rundt.
* Gasser: Partikler er langt fra hinanden og bevæger sig tilfældigt.
Denne forskel i partikeladfærd fører til de forskellige egenskaber, vi forbinder med hver stofstilstand.
 Varme artikler
Varme artikler
-
 Langvarig og præcis dosering af medicin takket være en olie-hydrogelblandingProfessor Job Boekhoven og Caren Wanzke ved det tekniske universitet i München opdagede et nyt materialesystem, der kan frigive lægemidler med en konstant frigivelseshastighed over en afstemmelig peri
Langvarig og præcis dosering af medicin takket være en olie-hydrogelblandingProfessor Job Boekhoven og Caren Wanzke ved det tekniske universitet i München opdagede et nyt materialesystem, der kan frigive lægemidler med en konstant frigivelseshastighed over en afstemmelig peri -
 Forskere tilføjer orden til polymergelerEn prøve af den nye homogene polymergel. Kredit:© 2019 Li et al. Gel-lignende materialer har en lang række anvendelser, især inden for kemi og medicin. Imidlertid, deres anvendelighed er undertide
Forskere tilføjer orden til polymergelerEn prøve af den nye homogene polymergel. Kredit:© 2019 Li et al. Gel-lignende materialer har en lang række anvendelser, især inden for kemi og medicin. Imidlertid, deres anvendelighed er undertide -
 Forskere opdager, hvordan overflader kan have hjulpet tidligt liv på Jorden med at begyndeSpontant dannede protoceller, som ligner balloner forankret til en overflade af et netværk af reb, visualiseres ved 3D konfokal mikroskopi. Kredit:Irep Gözen På den tidlige jord, en række spontane
Forskere opdager, hvordan overflader kan have hjulpet tidligt liv på Jorden med at begyndeSpontant dannede protoceller, som ligner balloner forankret til en overflade af et netværk af reb, visualiseres ved 3D konfokal mikroskopi. Kredit:Irep Gözen På den tidlige jord, en række spontane -
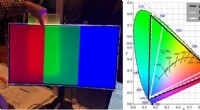 Oprettelse af skærme med rigere farver(Venstre) Foto, der viser farveforbedringseffekten ved brug af en prototype af den perovskitbaserede film. Når filmen placeres mellem baggrundsbelysningsenheden og skærmen, en spektral renere rød og g
Oprettelse af skærme med rigere farver(Venstre) Foto, der viser farveforbedringseffekten ved brug af en prototype af den perovskitbaserede film. Når filmen placeres mellem baggrundsbelysningsenheden og skærmen, en spektral renere rød og g
- Hvad er 5 abiotiske faktorer, der påvirker Saguaro National Park -økosystemet, og hvorfor?
- En super-pust planet som ingen anden
- Sådan beregnes gennemsnitsvolumen
- Hvordan man laver net ioniske ligninger i kemi
- Visualisering af intracellulære nanostrukturer af levende celler ved hjælp af nanoendoskopi-AFM
- Hvilke to planeter har en unik rotationer?


