Visualisering af intracellulære nanostrukturer af levende celler ved hjælp af nanoendoskopi-AFM

3D nanoendoskopi-AFM teknik. (A) Skematisk af 3D nanoendoscopy-AFM metoden, hvor nanoproben gentagne gange introduceres inde i cellen på forskellige positioner i det ønskede område. (B) FIB-fabrikeret nanoprobe brugt i 3D nanoendoskopi-AFM målinger. (C og D) Typiske F-z-kurver opnået, der penetrerer en celle, hvor et brat fald i cantilever-afbøjningen er afbildet som en top, når nanoproben penetrerer den ydre cellemembran (C), der fremstår som en anden top i tilfælde af, at nanoproben gennemborer kernemembranen (D). (G) 3D nanoendoskopi-AFM-cellekort over hele HeLa-cellevolumenet (40 × 40 × 6 μm3) indesluttet i den røde firkant i (E), hvor cellemembranen, cellekernen og cytoplasmatiske regioner kan skelnes i tværsnittet vist i (H). (I) 3D nanoendoskopi-AFM-billede af et HeLa-cellevolumen (10 × 10 × 6 μm3) indesluttet i den røde firkant i (F), hvor interne granulære strukturer tydeligt kan genkendes. Kredit:Science Advances , 10.1126/sciadv.abj4990
Atomic force microscopy (AFM) tilbyder en metode til etiketfri billeddannelse af biomolekylær dynamik i nanoskala for at løse biologiske spørgsmål, der ikke kan løses via andre bioimaging metoder, herunder fluorescens og scanning elektronmikroskopi. Da sådanne billeddannelsesmetoder kun er mulige for biologiske systemer udvundet fra celler eller rekonstrueret på faste substrater, forbliver nanodynamik i levende celler stort set utilgængelig med eksisterende biobilleddannelsesmetoder. I en ny rapport, der nu er offentliggjort i Science Advances , Marcos Penedo og et forskerhold i Nanolife Science og bioteknologi ved Kanazawa University i Japan, overvandt grænserne for bioimaging ved at bruge nanoendoskopi-AFM. Under processen indsatte de en nålelignende sonde i en levende celle for at præsentere actinfiber, tredimensionelle (3D) kort og 2D nanodynamik af membranens indre stillads med uopdagelige ændringer i cellelevedygtighed. I modsætning til tidligere AFM-metoder fik nanoproben direkte adgang til de intracellulære målkomponenter og udforskede AFM's muligheder, herunder højopløsningsbilleddannelse, nanomekanisk kortlægning og molekylær genkendelse for at udvide det observerbare udvalg af intracellulære strukturer i levende celler.
Biobilleddannelse af intracellulær dynamik
Molekylær skala dynamik af intracellulære komponenter giver indsigt i de grundlæggende mekanismer for cellefunktioner og sygdom. Imidlertid er direkte billeddannelsesmetoder til sådan nanodynamik i levende celler udfordrende. For eksempel, mens elektronmikroskopi er nyttig til at afbilde nanostrukturer af frosne celler i vakuum, er de ude af stand til at afbilde nanodynamik i levende celler under fysiologiske miljøer, undtagen som statiske øjebliksbilleder af faste konformationer. På samme måde, mens fluorescensmikroskopi via fluorescensmærkning giver en kraftfuld metode til at visualisere dynamikken af proteiner og organeller i levende celler, er de begrænset af en manglende evne til effektivt at afbilde på nanoskala. Der er derfor store krav til en mærkefri intracellulær billeddannelsesmetode i flydende miljøer. Atomic force microscopy (AFM) er en potentiel kandidat til rollen med kapacitet til at afbilde på sub-nanometer skala for at visualisere nanodynamik af lipider, proteiner og DNA'er uden mærker. Sådanne billeder er imidlertid ikke repræsentative for biologiske systemer som et resultat af ekstraktion fra en celle eller rekonstruktion på et fast substrat in vitro. I dette arbejde har Penedo et al. foreslået en AFM-baseret billeddannelsesmetode kendt som nanoendoskopi-AFM til at observere nanodynamik inde i levende celler uden at mærke eller skille dem ad.
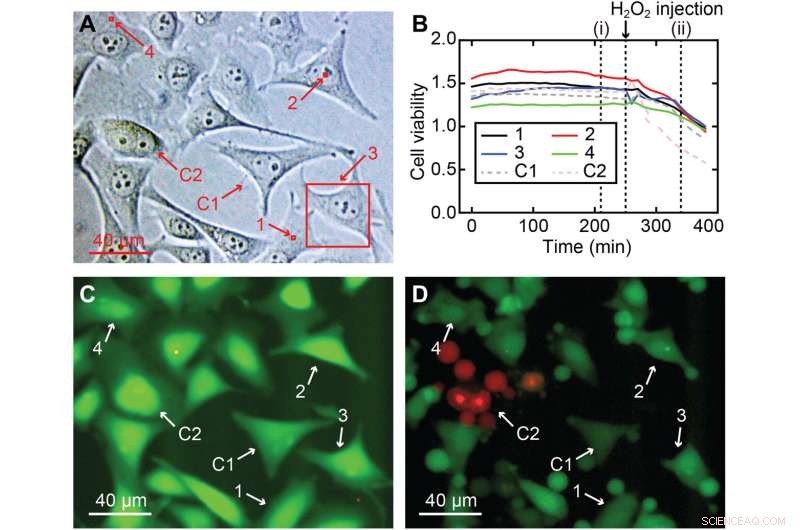
Cellelevedygtighed af 3D nanoendoskopi-AFM målinger. (A) Forskellige målte områder udført i en HeLa-cellekultur til cellelevedygtighedstesten, inklusive kerne- og celleperifere regioner:(1) 2 × 2 × 7 μm3, (2) 2 × 2 × 10 μm3, (3) 40 × 40 × 8 μm3, og (4) 2 × 2 × 7 μm3, fremhævet i røde firkanter; to celler blev brugt som kontrol, Cl og C2. (B) Cellelevedygtighedsforhold over tid for de fire afbildede celler (1 til 4) og for de to celler, der blev brugt som en kontrol (C1 og C2), hvilket viser, at alle cellerne (billedet og kontrol) havde en lignende fladcelles levedygtighedsintensitet forhold og bekræfter, at cellerne ikke var meget beskadigede. (C) Eksempel på et fluorescensbillede efter 210 minutter svarende til (i) i (B), hvor den stærke grønne farve betyder en normal esteraseaktivitet forventet for en levende celle. For at kontrollere validiteten af assayet blev H2O2 tilsat efter 260 minutter til mediet for at dræbe cellerne, hvilket resulterede i et fald i cellelevedygtighedsforholdet for alle celler, en klar indikation af, at celler var ved at dø. (D) Fluorescens-øjebliksbillede svarende til tidspunktet (ii) i (B), hvor tegn på skade er tydeligt synlige i alle celler, hvoraf de fleste allerede har lidt krympning eller apoptose. Kredit:Science Advances , 10.1126/sciadv.abj4990
Nanoendoskopi-AFM-eksperimenter
Under eksperimenterne, ligesom et endoskopisk kamera, indsatte forskerne en lang nållignende nanoprobe inde i en levende celle for at udføre 2D- og 3D AFM-billeddannelse. Holdet viste, hvordan nanoendoskopi-AFM gav en unik fordel for mærkefri intracellulær levende-celle-billeddannelse på nanoskala. Metoden giver en stærk vej til at observere hidtil uudforskede fænomener i biologiske systemer. Penedo et al. gentagne gange indført nanoproben inde i cellen ved forskellige positioner af det ønskede område via kraft versus afstand kurvemålinger. For at afbilde hele cellen skulle nanoproben være lang nok til at trænge fuldstændigt ind i cellen, indtil den nåede substratet, og med diametre under 200 nm for at minimere celleskade, samtidig med at membrangennemtrængning blev lettere. Holdet brugte en kommerciel silicium tetraedrisk spids som en nanoprobe, som de fræsede ved hjælp af fokuseret ionstrålefræsning til de foretrukne dimensioner. Holdet brugte derefter nanoproberne inde i forskellige områder af en HeLa-celle. De erhvervede et 3D nanoendoskopi-AFM-billede af en hel celle under eksperimenterne og identificerede kernen af HeLa-cellen fra resten af cellen. Yderligere målinger viste også de indre granulære strukturer. For at minimere celleskade under penetration, har Penedo et al. reduceret indtrængningskraften og fordybningslængden så meget som muligt. De udførte også cellelevedygtighedseksperimenter for at bekræfte, at 3D nanoendoskopi-AFM ikke førte til alvorlig celleskade ved brug af nanoprober med diametre under 200 nm. Ved hjælp af 3D nanoendoskopi-AFM lettede de billeddannelse af det indre cytoskelet i levende celler for at observere 3D-organisering af de ikke-understøttede fibre. Holdet har også succesfuldt fusioneret intracellulære billeder som følge af 3D nanoendoskopi-AFM og konfokal mikroskopi.

Kombination af konfokal billeddannelse og 3D nanoendoskopi-AFM. (A) Konfokalt fluorescensbillede, hvor de farvede actinfilamenter er synlige. (B) Det forstørrede billede opnået ved det område, der er angivet med den røde firkant i (A). (C og D) 3D nanoendoskopi-AFM-kort af cytoskelet-aktinfibre opnået i området fremhævet af den røde firkant i (B), hvor de Z lodrette positioner af de forskellige actinfilamenter (røde pile) og de øvre og nedre cellemembraner løses samtidigt. Det semitransparente billede vist i den røde firkant i (B) svarer til 2D-projektionen af 3D-kortene vist i (C) og (D). Kredit:Science Advances , 10.1126/sciadv.abj4990
2D nanoendoskopi-AFM
Evnen til at indsætte en lang nanoprobe i en celle mange gange og samtidig bevare cellelevedygtighed indebar potentialet til at lokalisere spidsen af sonden i en levende celle for at udføre lokale 2D/3D AFM-målinger uden væsentlig skade. Nanoproben kunne indsættes i cellen for at måle den cytoplasmatiske side af cellemembranen via amplitudemodulationstilstand AFM. Nanoproberne skulle være lange nok til at trænge helt ind i cellen og nå dens bund, samtidig med at de var tynde nok til at reducere celleskader. For at opnå dette i praksis har Penedo et al. udviklede nanoprober lavet af amorft kulstof ved hjælp af elektronstråleaflejring og målte amplitudeafhængigheden af afstanden, for at bestemme cellens integritet. De udførte 2D nanoendoskopi-AFM eksperimenter ved hjælp af en fibroblastcelle for at illustrere den retikulære struktur af den indre cellemembran og observerede cellearkitekturen for at studere indre dynamik af cellestrukturer. Arbejdet fremhævede muligheden for at bruge 2D nanoendoskopi-AFM til at studere nanodynamik af interne strukturer i levende celler under fysiologiske miljøer.

2D nanoendoskopi-AFM teknik. (A) Illustration af 2D nanoendoskopi-AFM-metoden, hvor nanoproben indsættes inde i cellen for at måle den cytoplasmatiske side af cellemembranen ved amplitudemodulationstilstand AFM. (B) Eksempel på en EBD-fremstillet nanoprobe brugt i 2D nanoendoskopi-AFM, hvor længden af nålen skal være lang nok til at trænge helt ind i cellen og nå dens nederste del og tynd nok til at reducere celleskaden. (C) Registreret kraft (øverst) og amplitude (nederst) versus afstandskurver for præcist at lokalisere den øvre og den nedre cellemembran:Den lodrette kraft er nul, når nanosonden er langt væk, og stiger, så snart nanosonden rører den øvre cellemembran; bagefter præsenterer det et plateau, der svarer til det indre cytoplasmatiske domæne, indtil kurven igen stiger kraftigt, når nanoproben når den nederste cellemembran. Amplitudeindstillingspunktet for reguleringen af spids-prøveafstand skal være lav nok til at sikre, at spidsen banker på cellens bundoverflade. (F) Konsekutive 2D nanoendoskopi-AFM 1 μm × 1 μm billeder udført på en BALB/3T3 fibroblast på området fremhævet af den røde prik afbildet i (D), der viser den retikulære struktur af den indre overflade af cellemembranen, der danner dens stillads og også membranudsvingene under målingerne. (G) Zoomet område af billederne vist i (F), plotter et snit mellem punkt A og B (E), hvor to fremspring adskilt af 25 nm tydeligt opløses i billedet. Kredit:Science Advances , 10.1126/sciadv.abj4990
Outlook
På denne måde viste Marcos Penedo og kolleger anvendelserne af nanoendoskopi-AFM til at måle cytoplasmatiske indre overflader af cellemembraner og tilhørende stilladser for at forstå 3D-arrangement af actinfilamenter i deres naturlige intracellulære miljø i levende celler. Holdet forsøgte at minimere celleskade ved at bruge ultratynde nålelignende nanoprober i eksperimenterne. De foreslåede AFM-metoder producerede 3D-kort over interne cellestrukturer ud over 2D-projektioner kombineret med eksisterende fluorescensmetoder såsom konfokal eller superopløsningsmikroskopi. Metoden vil kaste lys over cellemaskineri i aktion, in vivo, samtidig med at fysiologiske molekylære motorer eksponeres. Metoden vil også åbne nye muligheder for at studere intracellulær nanomekanik, der spiller en vigtig rolle i cellulære funktioner. Holdet kan bruge metoden til at måle kernens stivhed, adhæsion og spredningsegenskaber til at udtrække biologisk information, der er egnet til tværfaglige områder inden for cellebiologi og medicin. + Udforsk yderligere
Ny billedbehandlingsmetode giver et levende indblik i, hvordan celler fungerer
© 2022 Science X Network
 Varme artikler
Varme artikler
-
 Team gør orienteringen af magnetisme justerbar i nye materialerKredit:University of Twente Nanoteknologer ved UT -forskningsinstituttet MESA+ er nu i stand til at skabe materialer, hvor de kan påvirke og præcist styre magnetismens orientering efter behag. Et
Team gør orienteringen af magnetisme justerbar i nye materialerKredit:University of Twente Nanoteknologer ved UT -forskningsinstituttet MESA+ er nu i stand til at skabe materialer, hvor de kan påvirke og præcist styre magnetismens orientering efter behag. Et -
 Hurtigere kolloide fluorescensemittere:NanoblodpladerTransmissionselektronmikroskopbilleder af CdSe kolloide nanoplader. Forskellige laterale former (a-d) kan opnås ved brug af forskellige prækursorer. Skala søjler:b) 20nm, andre, 10 nm. Kredit:Benoit D
Hurtigere kolloide fluorescensemittere:NanoblodpladerTransmissionselektronmikroskopbilleder af CdSe kolloide nanoplader. Forskellige laterale former (a-d) kan opnås ved brug af forskellige prækursorer. Skala søjler:b) 20nm, andre, 10 nm. Kredit:Benoit D -
 En elektrisk ledning på få atomer bredEPFL-forskere viste, at det er muligt at skabe en elektrisk kanal på få atomer i todimensionelle isoleringsmaterialer. Deres simuleringer åbner nye perspektiver for produktionen af nye elektroniske
En elektrisk ledning på få atomer bredEPFL-forskere viste, at det er muligt at skabe en elektrisk kanal på få atomer i todimensionelle isoleringsmaterialer. Deres simuleringer åbner nye perspektiver for produktionen af nye elektroniske -
 3D-design fører til første stabile og stærke selvsamlende 1D nanografen ledningerSkematisk illustration af hierarkiske strukturer af kulstof nanofiber bundter lavet af bidt skæve nanographene molekyler. Kredit:NINS/IMS Nanografen er fleksibelt, dog stærkere end stål. Med unikk
3D-design fører til første stabile og stærke selvsamlende 1D nanografen ledningerSkematisk illustration af hierarkiske strukturer af kulstof nanofiber bundter lavet af bidt skæve nanographene molekyler. Kredit:NINS/IMS Nanografen er fleksibelt, dog stærkere end stål. Med unikk
- Biden-administrationen standser olieboring i Alaskas dyrereservat
- Hvad er UFO'er egentlig?
- Computermodel til design af proteinsekvenser, der er optimeret til at binde til lægemiddelmål
- Skeleton Project Ideas
- Sådan beregnes millimoler til milligrams
- COVID-19 genopretning er en chance for at forbedre det afrikanske fødevaresystem


