Hvordan opløses salt i vand?
Processen:
1. Polaritet: Vandmolekyler (H₂O) er polære, hvilket betyder, at de har en lidt positiv ende (hydrogenatomer) og en lidt negativ ende (iltatom). Tabel salt (NaCl) er sammensat af natrium (Na+) og chlorid (Cl-) ioner, der holdes sammen af ioniske bindinger.
2. attraktion: De positive ender af vandmolekyler tiltrækkes af de negative chloridioner (Cl-) i salt, og de negative ender af vandmolekyler tiltrækkes af de positive natriumioner (Na+).
3. Omgivende: Vandmolekyler omgiver saltioner og danner en hydratiseringsskal omkring hver ion. Dette svækker effektivt de ioniske bindinger, der holder saltkrystallen sammen.
4. adskillelse: Den stærke tiltrækning mellem vandmolekyler og saltioner overvinder tiltrækningen mellem natrium- og chloridioner. Ionerne går i stykker og bliver omgivet af vandmolekyler.
5. dissociation: Saltkrystallen opdeles i individuelle natrium- og chloridioner, som nu er fri til at bevæge sig rundt i opløsningen.
Nøglepunkter:
* Energi er påkrævet: Mens opløsningsprocessen forekommer spontan, kræver den energi for at bryde bindingerne, der holder saltkrystallen sammen. Denne energi kommer fra samspillet mellem vandmolekylerne og saltioner.
* ligevægt: Opløsning er en ligevægtsproces. Når salt opløses, øges koncentrationen af ioner i vandet. Til sidst bremser hastigheden for opløsning, og hastigheden af ioner, der rekombineres til dannelse af saltkrystaller, bliver lige. Dette punkt er kendt som mætning.
i enklere termer: Forestil dig saltkrystallerne som en gruppe dansere, der holder hænder. Vandmolekylerne, som en sverm af energiske bier, surrer rundt om danserne, der trækker på deres hænder. Biernes energi overvinder til sidst dansers greb, hvilket får dem til at adskille sig og danse frit med bierne.
Sidste artikelHvilket metal bruges i klinisk termometer?
Næste artikelBarium er hvilken type element?
 Varme artikler
Varme artikler
-
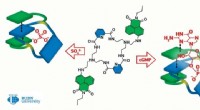 Kemikere skaber et molekyle, der kan hjælpe med at behandle hjertesygdomme og opdage viraKredit:RUDN Universitet RUDN University kemikere sammen med kolleger fra Chemnitz University of Technology (Tyskland) har syntetiseret den første kemiske receptor, der effektivt kan binde til cykl
Kemikere skaber et molekyle, der kan hjælpe med at behandle hjertesygdomme og opdage viraKredit:RUDN Universitet RUDN University kemikere sammen med kolleger fra Chemnitz University of Technology (Tyskland) har syntetiseret den første kemiske receptor, der effektivt kan binde til cykl -
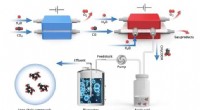 Hybrid elektro-biosystem opcykler kuldioxid til energirige langkædede forbindelserSkematisk diagram af in vitro kuldioxidsyntese af højenergi-langkædede fødevaremolekyler. Kredit:SIAT Kunstig upcycling af kuldioxid (CO2 ) til værditilvækstprodukter på en bæredygtig måde repræsen
Hybrid elektro-biosystem opcykler kuldioxid til energirige langkædede forbindelserSkematisk diagram af in vitro kuldioxidsyntese af højenergi-langkædede fødevaremolekyler. Kredit:SIAT Kunstig upcycling af kuldioxid (CO2 ) til værditilvækstprodukter på en bæredygtig måde repræsen -
 Madmekanik opskrift til at servere sund mad, der holderKredit:Queensland University of Technology (QUT) QUT-forskere arbejder på at designe hurtigere, billigere, og bedre måder at opbevare mad på. Udgivet i journal PLOS One , forskere brugte QUTs s
Madmekanik opskrift til at servere sund mad, der holderKredit:Queensland University of Technology (QUT) QUT-forskere arbejder på at designe hurtigere, billigere, og bedre måder at opbevare mad på. Udgivet i journal PLOS One , forskere brugte QUTs s -
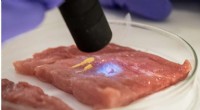 Forskere udvikler biogummilim til hurtigere kirurgisk bedring og smertelindringFlydende CaproGlu påført kød, der er hærdet med UV-lys, bliver til biogummi. Kredit:Nanyang Technological University Materialeforskere fra Nanyang Technological University, Singapore (NTU Singapor
Forskere udvikler biogummilim til hurtigere kirurgisk bedring og smertelindringFlydende CaproGlu påført kød, der er hærdet med UV-lys, bliver til biogummi. Kredit:Nanyang Technological University Materialeforskere fra Nanyang Technological University, Singapore (NTU Singapor
- Når bordsalt opløses i vand, er det en fysisk eller kemisk egenskab?
- Hvordan statsgarantier giver bankkunder ro i sindet og holder banker åbne
- Sådan ændres en magnets polaritet
- Hvor forekommer transkription i en eukaryotisk celle?
- Hvad er hypotesen for stivelse?
- Kunstig intelligens stiller spørgsmål til krigens natur:Mattis


