Hvad afhænger smeltning og kogepunkt af?
1. Intermolekylære kræfter:
* styrke af intermolekylære kræfter: Stærkere intermolekylære kræfter kræver mere energi til at overvinde, hvilket fører til højere smelte- og kogepunkter. Disse kræfter inkluderer:
* Hydrogenbinding: Den stærkeste type intermolekylær kraft, der findes i molekyler, der indeholder H bundet til N, O eller F.
* dipol-dipolinteraktioner: Forekommer mellem polære molekyler på grund af permanente dipoler.
* London Dispersion Forces: Svageste type, der findes i alle molekyler på grund af midlertidige udsving i elektronfordelingen.
* type intermolekylære kræfter: Den tilstedeværende krafttype dikterer dens styrke og dermed smelte/kogepunktet. Hydrogenbinding er den stærkeste, efterfulgt af dipol-dipol og derefter London-spredningskræfter.
2. Molekylær struktur:
* størrelse og form af molekyler: Større og mere komplekse molekyler har større overfladeareal, hvilket fører til stærkere London -spredningskræfter og højere smeltnings-/kogepunkter.
* Filial: Forgrening i molekyler reducerer overfladearealet og svækker intermolekylære kræfter, hvilket resulterer i lavere smelte/kogepunkter.
3. Tryk:
* eksternt tryk: Øget tryk øger generelt smeltepunktet og kogepunktet. Dette skyldes, at presset kræfter molekyler tættere sammen, hvilket gør det sværere at bryde intermolekylære kræfter.
4. Urenheder:
* tilstedeværelse af urenheder: Urenheder forstyrrer det regelmæssige arrangement af molekyler i en fast eller væske, svækkende intermolekylære kræfter og sænker smelte/kogepunktet.
5. Andre faktorer:
* obligationsstyrke: Kovalente bindinger inden for et molekyle er typisk meget stærkere end intermolekylære kræfter, men deres indflydelse på smeltning og kogepunkter er mindre signifikant.
* molekylær masse: Højere molekylmasse fører generelt til højere smelte- og kogepunkter på grund af stærkere London -spredningskræfter.
I resumé bestemmes smeltnings- og kogepunkterne for et stof af samspillet mellem disse faktorer, som i sidste ende påvirker styrken af de intermolekylære kræfter, der holder molekylerne sammen.
Sidste artikelHvad er elektrisk neutralt stof?
Næste artikelHvorfor faste og flydende har høje tætheder, mens gasens lave densiteter?
 Varme artikler
Varme artikler
-
 Tager et røntgenbillede af en atombindingVed at bruge store synchotron røntgenfaciliteter får forskere et bedre overblik over atombindinger. Kredit:Drexel University At forstå materialers adfærd ved deres grænseflader - hvor de forbinder
Tager et røntgenbillede af en atombindingVed at bruge store synchotron røntgenfaciliteter får forskere et bedre overblik over atombindinger. Kredit:Drexel University At forstå materialers adfærd ved deres grænseflader - hvor de forbinder -
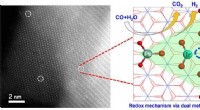 Forskere foreslår redox-mekanisme til vand-gas-skiftreaktionSynergetiske dual metal aktive steder af Ir 1 /FeO x SAC for WGS -reaktioner. Kredit:LIN Jian Vand-gas skift (WGS) reaktion (CO+H 2 O → CO 2 +H 2 ) er afgørende for fremstilling af hydro
Forskere foreslår redox-mekanisme til vand-gas-skiftreaktionSynergetiske dual metal aktive steder af Ir 1 /FeO x SAC for WGS -reaktioner. Kredit:LIN Jian Vand-gas skift (WGS) reaktion (CO+H 2 O → CO 2 +H 2 ) er afgørende for fremstilling af hydro -
 Katalysator muliggør reaktioner ved hjælp af grønt lysKolber indeholdende titaniumkatalysatoren og det røde farvestof, som bestråles med grønt lys i laboratoriet på Kekulé Institute of Organic Chemistry and Biochemistry ved universitetet i Bonn. Kredit:Z
Katalysator muliggør reaktioner ved hjælp af grønt lysKolber indeholdende titaniumkatalysatoren og det røde farvestof, som bestråles med grønt lys i laboratoriet på Kekulé Institute of Organic Chemistry and Biochemistry ved universitetet i Bonn. Kredit:Z -
 Pilotskalaanlæg til udvinding af sjældne jordartselementer i hjertet af kullandet(Venstre til højre) Rick Honaker, professor og formand for mineteknik, taler med assisterende forskningsprofessor Wencai Zhang, doktorand Alind Chandra og postdoc Honghu Tang. Kredit:University of Ken
Pilotskalaanlæg til udvinding af sjældne jordartselementer i hjertet af kullandet(Venstre til højre) Rick Honaker, professor og formand for mineteknik, taler med assisterende forskningsprofessor Wencai Zhang, doktorand Alind Chandra og postdoc Honghu Tang. Kredit:University of Ken
- Hvad er nogle landformer i San Andreas Fault?
- Chiles fyrreskove:en botanisk dinosaur på vej til udryddelse?
- Undersøgelse siger, at det sydlige Californiens jordskælv øgede stress på større brudlinje
- Forskere leder bakterier med udvidet genetisk kode til at udvikle ekstrem varmetolerance
- Hjælper hærens erfaring din civile karriere?
- Hvordan Camp X fungerede


