Hvordan ændrede Rutherfords fund Thomsons Plum Pudding -model?
Thomsons Plum Pudding Model:
* foreslået: J.J. Thomson foreslog denne model i 1904.
* Beskrivelse: Det afbildede atomet som en sfære af positivt ladet materiale med negativt ladede elektroner indlejret overalt, som blommer i en budding.
* antagelser: Denne model antog, at atomets masse og positive ladning blev jævnt fordelt.
Rutherfords guldfolieeksperiment:
* udført: Ernest Rutherford og hans studerende, Hans Geiger og Ernest Marsden, gennemførte dette eksperiment i 1911.
* Metode: De bombarderede et tyndt ark guldfolie med alfa -partikler (positivt ladede partikler).
* forventet resultat: Baseret på Thomsons model skulle alfa -partiklerne være gået lige gennem folien med minimal afbøjning, da den positive ladning antages at være jævnt fordelt.
* Faktisk resultat: Et overraskende antal alfa -partikler blev afbøjet i store vinkler, nogle sprang endda tilbage direkte mod kilden.
Rutherfords fund &den nukleare model:
* Atomet er for det meste tomt rum: Det faktum, at de fleste alfa -partikler passerede lige gennem guldfolien indikerede, at atomer for det meste er tomme rum.
* en tæt, positivt ladet kerne: De store afbøjninger og bagudspredning af nogle alfa -partikler antydede, at den positive ladning af atomet var koncentreret i en lille, tæt region kaldet kernen.
* Elektroner kredser om kernen: Baseret på observationer foreslog Rutherford, at de negativt ladede elektroner kredserede denne positivt ladede kerne.
Nøgleændringer til atommodellen:
* blommepudding -modellen var forkert. Den positive ladning er ikke jævnt fordelt over atomet; Det er koncentreret i en lille, tæt kerne.
* Atomet er for det meste tomt rum. Elektronerne kredserer kernen i en betydelig afstand, hvilket gør atomet for det meste tomme.
Rutherfords eksperiment revolutionerede vores forståelse af atomstruktur og banede vejen for yderligere opdagelser inden for nuklear fysik.
 Varme artikler
Varme artikler
-
 Nyt værktøj overvåger mutationer i realtid i influenzaEn influenzavirus binder sig til receptorer på en luftvejscelle, lader virussen trænge ind og inficere cellen. Kredit:U.S. Centers for Disease Control and Prevention Et team ledet af Rutgers har u
Nyt værktøj overvåger mutationer i realtid i influenzaEn influenzavirus binder sig til receptorer på en luftvejscelle, lader virussen trænge ind og inficere cellen. Kredit:U.S. Centers for Disease Control and Prevention Et team ledet af Rutgers har u -
 Vurdering af den luftbårne overlevelse af bakterier i aerosoldråber fra hoste og nysVed at bruge den nye tilgang, skyer af aerosoldråber (f.eks. 40 vist på billedet) kan fanges og manipuleres, muliggør en simulering af deres miljøeksponering Kredit:University of Bristol Den luftb
Vurdering af den luftbårne overlevelse af bakterier i aerosoldråber fra hoste og nysVed at bruge den nye tilgang, skyer af aerosoldråber (f.eks. 40 vist på billedet) kan fanges og manipuleres, muliggør en simulering af deres miljøeksponering Kredit:University of Bristol Den luftb -
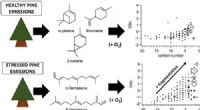 Bladlusstressede fyrretræer viser forskellig sekundær organisk aerosoldannelseKredit:American Chemical Society Planter udsender gasser, kaldet flygtige organiske forbindelser (VOCer), der kommer ind i atmosfæren, hvor de kan interagere med andre naturlige og menneskeskabte
Bladlusstressede fyrretræer viser forskellig sekundær organisk aerosoldannelseKredit:American Chemical Society Planter udsender gasser, kaldet flygtige organiske forbindelser (VOCer), der kommer ind i atmosfæren, hvor de kan interagere med andre naturlige og menneskeskabte -
 Biokemikere løser mysterier af cellulær form, fungereDe fremtrædende professorer Karolin Luger (til venstre) og Natalie Ahn ved Jennie Smoly Caruthers Biotechnology Building. Kredit:Glenn J. Asakawa / University of Colorado Boulder Den komplekse ind
Biokemikere løser mysterier af cellulær form, fungereDe fremtrædende professorer Karolin Luger (til venstre) og Natalie Ahn ved Jennie Smoly Caruthers Biotechnology Building. Kredit:Glenn J. Asakawa / University of Colorado Boulder Den komplekse ind
- Rettelse til synkrotronforskningsfejl kan forbedre resultaterne
- Scanning af tunnelmikroskopi afslører uventet optisk fononeffekt
- Er saccharose en grundstofforbindelse homogen blanding eller heterogen blanding?
- Jordbrugsværktøjer i det gamle egypten
- Kan du spørge en gris, om hans glas er halvt fyldt?
- Hvad er navnene på to husholdninger?


