Hvorfor opløses nogle gasser i vand?
1. Intermolekylære kræfter:
* Hydrogenbinding: Polære gasser som ammoniak (NH3) og hydrogenchlorid (HCI) kan danne hydrogenbindinger med vandmolekyler, hvilket øger deres opløselighed.
* dipol-dipolinteraktioner: Polære gasser som kuldioxid (CO2) kan interagere med vandmolekyler gennem dipol-dipolinteraktioner, hvilket gør dem noget opløselige.
* London Dispersion Forces: Selv ikke -polære gasser som ilt (O2) og nitrogen (N2) kan opleve svage London -spredningskræfter med vandmolekyler. Disse kræfter er svagere end hydrogenbinding og dipol-dipol-interaktioner, hvilket resulterer i lavere opløselighed.
2. Delvis pres og Henrys lov:
* Delvis tryk: Opløseligheden af en gas i en væske er direkte proportional med dets delvise tryk over væsken. Højere delvis tryk betyder, at flere gasmolekyler kolliderer med den flydende overflade og opløses. Dette er grunden til, at kulsyreholdige drikkevarer har mere fizz, når de er frisk åbnet - presset inde i flasken er højere.
* Henrys lov: Denne lov siger, at opløseligheden af en gas i en væske er direkte proportional med dens delvise tryk over væsken ved en konstant temperatur.
3. Temperatur:
* opløselighed falder med stigende temperatur: Når temperaturen stiger, øges den kinetiske energi af gasmolekyler, hvilket gør det lettere for dem at flygte fra væskefasen og vende tilbage til gasfasen.
4. Gasens art:
* Polaritet: Polære gasser er generelt mere opløselige i vand end ikke -polære gasser.
* Størrelse og form: Mindre gasmolekyler har en tendens til at være mere opløselige end større, da de lettere kan passe ind i mellemrummet mellem vandmolekyler.
5. Andre faktorer:
* saltholdighed: Tilstedeværelsen af salte i vand kan påvirke gasopløselighed.
* tryk: Øget tryk kan tvinge flere gasmolekyler til opløsning.
Kortfattet:
Opløseligheden af en gas i vand er et komplekst fænomen bestemt af en kombination af intermolekylære kræfter, delvis tryk, temperatur og gasens art. Polære gasser med stærke intermolekylære interaktioner har en tendens til at være mere opløselige i vand end ikke -polære gasser.
Sidste artikelHvorfor bruger videnskabsmand Robert Hazen trykbomber til at sprænge mineraler?
Næste artikelHvorfor ser vi vandmolekyler?
 Varme artikler
Varme artikler
-
 Undersøgelse afslører korrosionsmekanisme af magnesiumlegeringer i marine atmosfærisk miljøDe optiske fotografier af mikrostruktur for Mg-5Y-1.5Nd-xZn-0.5Zr (x = 0, 2, 4, 6 wt.%) legeringer. Kredit:Journal of Magnesium and Alloys (2022). DOI:10.1016/j.jma.2022.03.007 Magnesiumlegeringer
Undersøgelse afslører korrosionsmekanisme af magnesiumlegeringer i marine atmosfærisk miljøDe optiske fotografier af mikrostruktur for Mg-5Y-1.5Nd-xZn-0.5Zr (x = 0, 2, 4, 6 wt.%) legeringer. Kredit:Journal of Magnesium and Alloys (2022). DOI:10.1016/j.jma.2022.03.007 Magnesiumlegeringer -
 Redoxdivergerende strategi til konstruktion af (dihydro)thiophener med dimethylsulfoxidKredit:Pixabay/CC0 Public Domain (dihydro)thiophener, blandt de mest almindelige femleddede heterocykler, er udbredt i et stort antal naturlige produkter, funktionelle materialer, og biologisk akt
Redoxdivergerende strategi til konstruktion af (dihydro)thiophener med dimethylsulfoxidKredit:Pixabay/CC0 Public Domain (dihydro)thiophener, blandt de mest almindelige femleddede heterocykler, er udbredt i et stort antal naturlige produkter, funktionelle materialer, og biologisk akt -
 Fysiksteamet undersøger indflydelse af ioner på atombevægelserComputersimuleringer af bevægelsen på tværs af overfladen af et metal (orange) tyder på, at svovlatomer (gul) i nærværelse af et lag bromidioner (magenta) ændrer deres position ved kortvarigt at dyp
Fysiksteamet undersøger indflydelse af ioner på atombevægelserComputersimuleringer af bevægelsen på tværs af overfladen af et metal (orange) tyder på, at svovlatomer (gul) i nærværelse af et lag bromidioner (magenta) ændrer deres position ved kortvarigt at dyp -
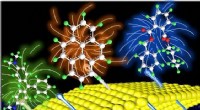 Ny Raman-metode fanger målmolekyler i små huller aktivtSkematisk diagram af princippet om den generelle overfladeforstærkede Raman-spektroskopimetode til aktivt at fange målmolekyler i små huller med opløsningsmidlet. Kredit:GE Meihong For nylig, Prof
Ny Raman-metode fanger målmolekyler i små huller aktivtSkematisk diagram af princippet om den generelle overfladeforstærkede Raman-spektroskopimetode til aktivt at fange målmolekyler i små huller med opløsningsmidlet. Kredit:GE Meihong For nylig, Prof
- Forskere forbedrer følsomheden og strækbarheden af rumtemperatur flydende metal-baserede sensor
- Forskere afslører en ny vej til at øge amning for ammende mødre
- Hvordan man opbygger en model af solsystemet ud af balloner
- Kvantefysik foreslår en ny måde at studere biologi på - resultaterne kan revolutionere vores fors…
- Når et stof skifter fra en fase til et andet, hvad sker der?
- Rapporten bekræfter, at 2016 var endnu et varmt år


