Når et stof skifter fra en fase til et andet, hvad sker der?
1. Energiændring:
* smeltning (fast til væske): Energi absorberes af stoffet for at bryde bindingerne, der holder molekylerne i en fast, stiv struktur.
* frysning (væske til fast): Energi frigøres, når molekylerne bremser ned og danner en mere ordnet struktur.
* fordampning (væske til gas): Energi absorberes for at overvinde de intermolekylære kræfter, der holder væsken sammen.
* kondens (gas til væske): Energi frigøres, når gasmolekylerne bremser ned og kommer nærmere sammen.
* sublimering (fast til gas): Energi absorberes for direkte at omdanne et fast stof til en gas, der omgår den flydende fase.
* deponering (gas til fast): Energi frigøres, når gasmolekylerne direkte omdannes til et fast stof.
2. Molekylær arrangement:
* fast: Molekyler er tæt pakket og arrangeret i en fast, stiv struktur.
* væske: Molekyler er tættere sammen end i en gas, men har mere frihed til at bevæge sig rundt.
* gas: Molekyler er langt fra hinanden og bevæger sig tilfældigt i høje hastigheder.
3. Densitetsændring:
* faste stoffer er typisk tættere end væsker.
* væsker er typisk tættere end gasser.
4. Entropiændring:
* entropi (graden af forstyrrelse) øges, når et stofovergange overgår fra fast til væske til gas.
5. Fysiske egenskaber:
* smeltepunkt: Temperaturen, hvormed en solid overgår til en væske.
* kogepunkt: Temperaturen, hvormed en flydende overgår til en gas.
* frysningspunkt: Temperaturen, hvormed en flydende overgår til et fast stof.
* sublimeringspunkt: Temperaturen, hvormed en fast stof overgår direkte til en gas.
* deponeringspunkt: Temperaturen, hvormed en gas direkte overgår til et fast stof.
Bemærk: De specifikke energiændringer, molekylær arrangement og fysiske egenskaber vil variere afhængigt af stoffet og de involverede betingelser.
Sidste artikelHvad er varme- og faseændringer?
Næste artikelHvilken organisk forbindelse, der kun indeholder enkeltbindinger?
 Varme artikler
Varme artikler
-
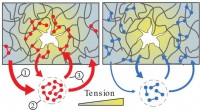 Udforsker, hvordan celler kan være stærke på det rigtige sted og på det rigtige tidspunktCatch bonds (rød) er svage i områder med lav spænding (1) og løsner derfor hurtigt (2). Disse ubundne binder igen på tilfældige steder i netværket, men binder kun tæt i højspændte områder (3), og fors
Udforsker, hvordan celler kan være stærke på det rigtige sted og på det rigtige tidspunktCatch bonds (rød) er svage i områder med lav spænding (1) og løsner derfor hurtigt (2). Disse ubundne binder igen på tilfældige steder i netværket, men binder kun tæt i højspændte områder (3), og fors -
 Blå svampefarvestof bruges til at udvikle nyt fluorescerende værktøj til cellebiologerAzuFluor er baseret på azulen, et lyseblåt kemikalie fundet i svampen Lactarius indigo. Kredit:Dan Molter Et nyt fluorescerende værktøj til påvisning af reaktive oxygenarter baseret på et kemikali
Blå svampefarvestof bruges til at udvikle nyt fluorescerende værktøj til cellebiologerAzuFluor er baseret på azulen, et lyseblåt kemikalie fundet i svampen Lactarius indigo. Kredit:Dan Molter Et nyt fluorescerende værktøj til påvisning af reaktive oxygenarter baseret på et kemikali -
 Dyrkning af polymerer med forskellige længderSymbolsk repræsentation af, hvordan spredningen af et plastik kan kontrolleres ved at blande to katalysatorer (malerør). Kredit:Whitfield R et al, Chem, 2020 ETH-forskere har udviklet en ny meto
Dyrkning af polymerer med forskellige længderSymbolsk repræsentation af, hvordan spredningen af et plastik kan kontrolleres ved at blande to katalysatorer (malerør). Kredit:Whitfield R et al, Chem, 2020 ETH-forskere har udviklet en ny meto -
 Efterligning af dykkerklokke-edderkoppen for at forbedre kulstofomdannelsen til brændstofCO2-reduktion som en kilde til bæredygtigt brændstof og en introduktion til plastroneffekten. en, Generering af vedvarende brændstof gennem CO2-reduktion og H2O-oxidation. b, Det kinetiske versus term
Efterligning af dykkerklokke-edderkoppen for at forbedre kulstofomdannelsen til brændstofCO2-reduktion som en kilde til bæredygtigt brændstof og en introduktion til plastroneffekten. en, Generering af vedvarende brændstof gennem CO2-reduktion og H2O-oxidation. b, Det kinetiske versus term
- Undersøgelse afslører, hvad naturlige drivhusemissioner fra vådområder og permafrost betyder for…
- Hvad er betydningen af 4D-tid i kontekst kvantefysik?
- FN advarer om mere ekstremt vejr forude efter det varmeste årti nogensinde
- Grundvand driver hurtig erosion af Canterbury-kysten, New Zealand
- Et afgørende enzym blev endelig afsløret
- Indonesiske øer betaler prisen for globalt hastværk med smartphones


