Hvad er de generelle egenskaber ved overgangsmetaller?
1. Elektronisk konfiguration:
-De er placeret i grupper 3-12 i den periodiske tabel mellem S-blokken og P-blokken.
- Deres definerende træk er tilstedeværelsen af delvist fyldte d orbitaler i deres atomer. Det er her de får deres navn, da deres elektronkonfigurationer "overgang" mellem de fyldte D -orbitaler i den forrige gruppe og de udfyldte D -orbitaler i den næste gruppe.
- De har et variabelt antal valenselektroner, som kan være involveret i binding. Dette giver dem mulighed for at danne flere oxidationstilstande, hvilket bidrager til deres forskellige kemiske opførsel.
2. Fysiske egenskaber:
- høje smelte- og kogepunkter: På grund af stærk metallisk binding er overgangsmetaller generelt hårde og tæt med høje smelte- og kogepunkter.
- gode ledere af varme og elektricitet: Deres D -elektroner bidrager til deres fremragende ledningsevne.
- Lustrøst udseende: De fleste overgangsmetaller har en skinnende metallisk glans.
- formbarhed og duktilitet: Mange er formbare (kan hamres i tynde lagner) og duktile (kan trækkes ind i ledninger).
3. Kemiske egenskaber:
- Variabel oxidation siger: Som nævnt kan de eksistere i flere oxidationstilstande, hvilket resulterer i en lang række kemiske forbindelser.
- formularfarvede forbindelser: Mange overgangsmetalforbindelser er farvet på grund af D-D-overgange, der opstår, når elektroner absorberer og udsender lys. Derfor ser vi en række farver i ædelsten og andre materialer.
- katalytisk aktivitet: De er ofte fremragende katalysatorer på grund af deres evne til let at ændre oxidationstilstande, hvilket letter kemiske reaktioner.
- Form komplekse ioner: Deres evne til at danne koordinere kovalente bindinger med ligander (elektronpardonorer) fører til dannelse af komplekse ioner.
- paramagnetisme: Mange overgangsmetaller udviser paramagnetisme, hvilket betyder, at de er svagt tiltrukket af magnetiske felter på grund af uparrede elektroner i deres D -orbitaler. Nogle, som jern, kobolt og nikkel, er ferromagnetiske, hvilket betyder, at de bevarer deres magnetisering, selv efter at magnetfeltet er fjernet.
4. Ansøgninger:
- metaller og legeringer: Brugt i konstruktion, maskiner, elektronik og mere.
- katalysatorer: Brugt i forskellige industrielle processer, som produktion af benzin, plast og farmaceutiske stoffer.
- pigmenter og farvestoffer: Brugt i maling, blæk og tekstiler.
- ædelsten: Mange overgangsmetaller er ansvarlige for de livlige farver på ædelsten.
- Biomolekyler: Overgangsmetaller som jern og kobber spiller vigtige roller i biologiske systemer.
Eksempler:
- jern (Fe): Brugt i stål og andre legeringer såvel som i blod til ilttransport.
- kobber (CU): Brugt i elektriske ledninger, VVS og mønter.
- nikkel (ni): Brugt i batterier, mønter og legeringer.
- guld (AU): Brugt i smykker, elektronik og tandlæge.
- titanium (Ti): Brugt i rumfartsapplikationer og medicinske implantater.
Det er vigtigt at huske, at der er undtagelser fra disse generelle egenskaber. Nogle overgangsmetaller er måske mindre reaktive end andre eller har forskellige farver eller smeltepunkter. De specifikke egenskaber ved hvert overgangsmetal påvirkes af dets elektroniske konfiguration og andre faktorer.
 Varme artikler
Varme artikler
-
 Hvorfor er visse tungmetaller okay at spise? (video)Kredit:The American Chemical Society Tungmetaller har ry for at være farlige, men nogle er essentielle næringsstoffer, som du ikke kan leve uden. I denne uges afsnit af Reaktioner , undersøger vi h
Hvorfor er visse tungmetaller okay at spise? (video)Kredit:The American Chemical Society Tungmetaller har ry for at være farlige, men nogle er essentielle næringsstoffer, som du ikke kan leve uden. I denne uges afsnit af Reaktioner , undersøger vi h -
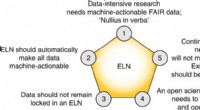 Kemisk datahåndtering:En åben vej fremDe fem kerneteser i dette perspektiv. Kredit:Nature Chemistry (2022). DOI:10.1038/s41557-022-00910-7 Et af de mest udfordrende aspekter af moderne kemi er håndtering af data. For eksempel, når de s
Kemisk datahåndtering:En åben vej fremDe fem kerneteser i dette perspektiv. Kredit:Nature Chemistry (2022). DOI:10.1038/s41557-022-00910-7 Et af de mest udfordrende aspekter af moderne kemi er håndtering af data. For eksempel, når de s -
 Rumtemperaturkonvertering af CO2 til CO:En ny måde at syntetisere kulbrinter påIllustration af en ny stuetemperaturproces til fjernelse af kuldioxid (CO 2 ) ved at omdanne molekylet til kulilte (CO). I stedet for at bruge varme, nanoskalametoden er afhængig af energien fra ove
Rumtemperaturkonvertering af CO2 til CO:En ny måde at syntetisere kulbrinter påIllustration af en ny stuetemperaturproces til fjernelse af kuldioxid (CO 2 ) ved at omdanne molekylet til kulilte (CO). I stedet for at bruge varme, nanoskalametoden er afhængig af energien fra ove -
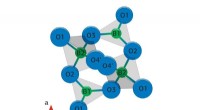 Kemikere opdager mekanismen for strålingsustabilitet af lithiumtetraboratKredit:RUDN Universitet Kemikere fra RUDN University har studeret mekanismen for strålingsustabilitet af termoluminoforer baseret på lithiumtetraborat, som bruges til fremstilling af strålingsdosi
Kemikere opdager mekanismen for strålingsustabilitet af lithiumtetraboratKredit:RUDN Universitet Kemikere fra RUDN University har studeret mekanismen for strålingsustabilitet af termoluminoforer baseret på lithiumtetraborat, som bruges til fremstilling af strålingsdosi
- Facebook blokerer det Iran-forbundne bud på at påvirke USA, Britisk politik
- Sådan løses binomial ligninger ved Factoring
- Hvad ville der ske, hvis du når kanten af en flad jord?
- Indfangning af cirkulerende kræftceller kunne give indsigt i, hvordan sygdom spredes
- Udsender neutronstjerner lys, og hvis ja, hvad er karakteren af dette udsendte lys?
- RoboTurk:En crowdsourcing -platform til efterligningslæring inden for robotik


