Hvordan beregnes molemasser eller mængder af gasser fra hinanden for en gas ved STP?
Forstå Stp
* STP (standardtemperatur og tryk): Defineret som 0 ° C (273,15 K) og 1 atm (101,325 kPa).
* molvolumen på STP: Hos STP optager en mol af enhver ideel gas 22,4 L.
Beregninger
1. mol til volumen (på STP):
* Formel: Volumen (l) =mol × 22,4 l/mol
* Eksempel: Hvis du har 2 mol iltgas (O₂), ville dens volumen ved STP være:2 mol × 22,4 l/mol =44,8 L
2. volumen til mol (på STP):
* Formel: Mol =volumen (L) / 22,4 L / mol
* Eksempel: Hvis du har 11,2 L nitrogengas (N₂), ville antallet af mol være:11,2 L / 22,4 L / mol =0,5 mol
3. mol til masse:
* Formel: Masse (g) =mol × molmasse (g/mol)
* Eksempel: For at finde massen på 0,5 mol kuldioxid (CO₂) har du brug for dens molære masse:
* Molmasse CO₂ =12,01 g/mol (C) + 2 × 16,00 g/mol (O) =44,01 g/mol
* Masse =0,5 mol × 44,01 g/mol =22,01 g
4. Masse til mol:
* Formel: Moles =masse (g) / molær masse (g / mol)
* Eksempel: Hvis du har 5,6 g nitrogengas (N₂), ville antallet af mol være:
* Molmasse på N₂ =2 × 14,01 g/mol =28,02 g/mol
* Mol =5,6 g / 28,02 g / mol =0,2 mol
Vigtige noter:
* Disse beregninger antager ideel gasadfærd. Ægte gasser kan afvige lidt fra idealitet, især ved høje tryk eller lave temperaturer.
* Det molære volumen på 22,4 L/mol gælder kun hos STP. Ved andre temperaturer og tryk ændres volumenet.
Lad mig vide, om du har flere specifikke spørgsmål om gasberegninger!
Sidste artikelHvordan adskiller du jernoxid og saltvand?
Næste artikelHvad er volumenet på 3,5 mol CO2 -gas ved STP?
 Varme artikler
Varme artikler
-
 Ny ionledende membran forbedrer alkaliske-zink-jernstrømsbatterierSelektiv iontransport og hydroxidiontransporten i LDHer. Kredit:HU Jing Alkaliske zink-jern strømningsbatterier (AZIFB) er velegnede til stationære energilagringsanvendelser på grund af fordelene
Ny ionledende membran forbedrer alkaliske-zink-jernstrømsbatterierSelektiv iontransport og hydroxidiontransporten i LDHer. Kredit:HU Jing Alkaliske zink-jern strømningsbatterier (AZIFB) er velegnede til stationære energilagringsanvendelser på grund af fordelene -
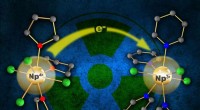 Åbner adgang til at udforske neptuniums syntetiske kemiEn ny, let fremstillet udgangsmateriale (til venstre) indeholdende neptunium (Np3+) kan let fremstilles ved en elektron (e-) overførsel til en moder neptunium (Np4+) forbindelse (højre). Denne proces
Åbner adgang til at udforske neptuniums syntetiske kemiEn ny, let fremstillet udgangsmateriale (til venstre) indeholdende neptunium (Np3+) kan let fremstilles ved en elektron (e-) overførsel til en moder neptunium (Np4+) forbindelse (højre). Denne proces -
 Katalytiske protoceller bliver nervøseMørkefeltmikroskopibillede af en enkelt multi-kompartmental kapsel indeholdende tusindvis af katalytiske protoceller, der nedbryder hydrogenperoxid til vand og oxygengas. Kredit:Dr. Pierangelo Gobbo o
Katalytiske protoceller bliver nervøseMørkefeltmikroskopibillede af en enkelt multi-kompartmental kapsel indeholdende tusindvis af katalytiske protoceller, der nedbryder hydrogenperoxid til vand og oxygengas. Kredit:Dr. Pierangelo Gobbo o -
 Polymerer bliver fanget af kærlighed-hadkemi af olie og vandForskere ved Oak Ridge National Laboratory og University of Tennessee sporede polymerselvsamling ved væske-væske-grænsefladen i realtid. Kredit:Michelle Lehman/Oak Ridge National Laboratory, US Depart
Polymerer bliver fanget af kærlighed-hadkemi af olie og vandForskere ved Oak Ridge National Laboratory og University of Tennessee sporede polymerselvsamling ved væske-væske-grænsefladen i realtid. Kredit:Michelle Lehman/Oak Ridge National Laboratory, US Depart
- Forskere afslører, at amerikanske majsafgrøder vokser følsomme over for tørke
- Visualisering af elektronflow motiverer nye enheder i nanoskala inspireret af flyvinger
- Multitalent mangrover:Spotlight på træerne, der kunne redde planeten
- Mikroplastik:Intet lille problem for filterfødende havgiganter
- Nanotermometre viser forskelle i første temperaturrespons i levende celler
- DNA slår et århundredegammelt mysterium om New Zealands kun uddøde ferskvandsfisk


