Hvad er meningen med udtrykket elektronegativitet?
Her er en sammenbrud af konceptet:
* atomer i en binding: Når atomer danner en kemisk binding, deler de elektroner.
* ulig deling: I nogle bindinger deles elektronerne ikke lige. Det ene atom har et stærkere træk på de delte elektroner end den anden.
* Elektronegativitet bestemmer trækningen: Elektronegativitet er en værdi, der kvantificerer denne trækkraft. Jo højere elektronegativitetsværdi, jo stærkere er trækket på de delte elektroner.
Nøglepunkter:
* skala: Elektronegativitet måles typisk på Pauling -skalaen, hvor fluor (F) har den højeste elektronegativitet (4,0), og Cesium (CS) har den laveste (0,7).
* obligationstype: Forskellen i elektronegativitet mellem to atomer i en binding kan forudsige den type binding, de vil danne:
* kovalente obligationer: Når forskellen i elektronegativitet er lille, betragtes bindingen som kovalent (elektroner deles relativt lige).
* polære kovalente obligationer: Når forskellen i elektronegativitet er større, betragtes bindingen som polær kovalente (elektroner deles ulige, hvilket skaber delvise ladninger på atomerne).
* ioniske bindinger: Når forskellen i elektronegativitet er meget stor, betragtes bindingen som ionisk (det ene atom tager helt elektronerne fra den anden).
* Forudsigelse af reaktivitet: Elektronegativitet kan bruges til at forudsige reaktiviteten af elementer og forbindelser. For eksempel har elementer med høj elektronegativitet en tendens til at være gode oxidationsmidler (de får elektroner).
Kortfattet: Elektronegativitet er et afgørende koncept i kemi, der hjælper os med at forstå arten af kemiske bindinger, fordelingen af elektroner i molekyler og reaktiviteten af elementer og forbindelser.
Sidste artikelHvad er 5 rene metaller?
Næste artikelProcedure inden for afhjælpning af materialevidenskab?
 Varme artikler
Varme artikler
-
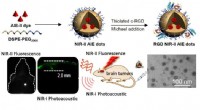 Ny metode hjælper med at gøre ortotopisk hjerne-tumor-billeddannelse klarere og hurtigereNIR-II fluorescerende molekyle med aggregeringsinduceret emission (AIE) brugt til ortotopisk hjernetumorbilleddannelse. Kredit:ZHENG Hairong I øjeblikket, tumorer inde i centralnervesystemet er bl
Ny metode hjælper med at gøre ortotopisk hjerne-tumor-billeddannelse klarere og hurtigereNIR-II fluorescerende molekyle med aggregeringsinduceret emission (AIE) brugt til ortotopisk hjernetumorbilleddannelse. Kredit:ZHENG Hairong I øjeblikket, tumorer inde i centralnervesystemet er bl -
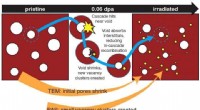 Ikke-destruktive positronstråler sondeskade, understøtte sikkerhedsfremskridt i strålingsmiljøerEn kombination af positron-annihilationsspektroskopi og transmissionselektronmikroskopi afslører ny indsigt i, hvordan skader dannes i bestrålede materialer, foreslår en mekanisme, hvor store huller i
Ikke-destruktive positronstråler sondeskade, understøtte sikkerhedsfremskridt i strålingsmiljøerEn kombination af positron-annihilationsspektroskopi og transmissionselektronmikroskopi afslører ny indsigt i, hvordan skader dannes i bestrålede materialer, foreslår en mekanisme, hvor store huller i -
 Maling af det molekylære lærred i superopløsningHoldet demonstrerede funktionerne i Action-PAINT på syntetiske DNA-nanostrukturer, der afslører identiske nærliggende dockingsteder for imager-strenge. I et første trin blev dockingstederne visualiser
Maling af det molekylære lærred i superopløsningHoldet demonstrerede funktionerne i Action-PAINT på syntetiske DNA-nanostrukturer, der afslører identiske nærliggende dockingsteder for imager-strenge. I et første trin blev dockingstederne visualiser -
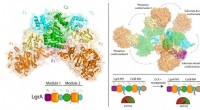 Ny forståelse af antibiotikasynteseKredit:McGill University Forskere ved McGill Universitys medicinske fakultet har gjort vigtige fremskridt med at forstå funktionen af enzymer, der spiller en integreret rolle i produktionen af
Ny forståelse af antibiotikasynteseKredit:McGill University Forskere ved McGill Universitys medicinske fakultet har gjort vigtige fremskridt med at forstå funktionen af enzymer, der spiller en integreret rolle i produktionen af
- Hvordan indsamler en videnskabsmand information?
- Clash of the crayfish:Hvorfor amerikanerne vinder
- Melonsmag afkodet:De genetiske nøgler til aromatisk mangfoldighed
- Ny forskning afslører at terahertz-bølger påvirker dynamikken i nanobundne vandmolekyler
- Mikrobielt mordmysterium opklaret
- Kirurgi i en pille en potentiel behandling for diabetes


