Ny forståelse af antibiotikasyntese
Kredit:McGill University
Forskere ved McGill Universitys medicinske fakultet har gjort vigtige fremskridt med at forstå funktionen af enzymer, der spiller en integreret rolle i produktionen af antibiotika og andre terapeutiske midler. Deres resultater er offentliggjort i Videnskab .
"Mange af de lægemidler, vi er afhængige af i dag, er naturlige produkter, lavet af jordens flora, " forklarer Dr. Martin Schmeing, Lektor i Institut for Biokemi ved McGill og undersøgelsens seniorforfatter. "Dette inkluderer forbindelser fremstillet i mikrober af massive enzymer kaldet ikke-ribosomale peptidsyntetaser, eller NRPS'er. NRPS'er syntetiserer alle slags antibiotika, som kan dræbe farlige svampe og bakterier, samt forbindelser til at hjælpe os med at bekæmpe virusinfektioner og kræftformer. For eksempel, disse forbindelser omfatter viomycin, et antibiotikum, der anvendes til behandling af multiresistent tuberkulose; cyclosporin, som i vid udstrækning er blevet brugt som et immunsuppressivt middel ved organtransplantationer; og det velkendte antibiotikum penicillin."
For at syntetisere disse stoffer, NRPS'er fungerer på samme måde som et fabrikssamlebånd, bestående af en række arbejdsstationer. Hver station, kaldet et "modul, "har arbejdsgange i flere trin og bevægelige dele, der gør det muligt at tilføje en byggestenskomponent til det voksende lægemiddel.
Forstå samlebåndets indre funktion
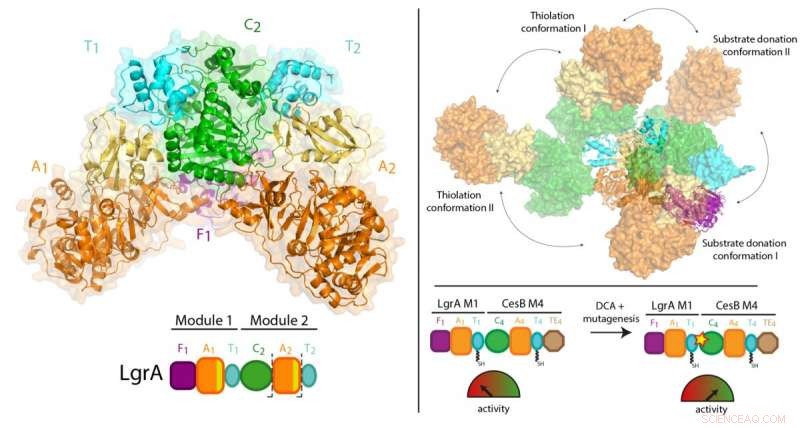
Tidligere arbejde af Dr. Schmeing og andre har ført til en solid forståelse af, hvordan ét modul fungerer. Nu, ved hjælp af en teknik kaldet røntgenkrystallografi ved den canadiske lyskilde i Saskatchewan, og Advanced Photon Source i Illinois, holdet var i stand til at tage 3D-billeder i ultrahøj opløsning af NRPS'erne.
For første gang, de var i stand til at lave højkvalitetsobservationer om, hvordan et individuelt modul forholder sig til det større samlebånd, ved at visualisere en to-modul del af NRPS'erne, der gør antibiotikaet lineært gramicidin (findes i Polysporin-behandlinger). Undersøgelsen fandt en overraskende mangel på synkronisering mellem moduler på alle andre punkter end når de skal koordinere for at videregive mellemproduktet fra den ene arbejdsstation til den næste. Derudover de fandt ud af, at modulerne ikke ligger i en lige linje eller på en anden organiseret måde, men kan i stedet stille op i mange forskellige relative positioner. "Dette niveau af massiv fleksibilitet var ikke forventet, " bemærker Dr. Schmeing, som også er direktør for McGill's Center for Structural Biology. "Enzymerne udfører gymnastik."
Fordi proteinerne er fanget i en krystal, Der blev sørget for at bekræfte, at resultaterne var repræsentative for, hvad der sker i det virkelige liv. Dr. Schmeing arbejdede sammen med sin kollega, Dr. Alba Guarné, Professor ved Institut for Biokemi ved McGill, at bruge supplerende løsningsdata, indsamlet ved Advanced Light Source i Berkeley for at validere observationerne. "Det strukturelle biologisamfund er meget stærkt hos McGill. Vi arbejder sammen for at hjælpe hinanden i samarbejder, at få det biofysiske udstyr, der kræves til banebrydende eksperimenter, og at træne vores elever" siger Dr. Schmeing, bemærker, at eksperimentalisterne på papiret, Janice Reimer, Max Eivaskhani og Ingrid Harb, er alle talentfulde McGill kandidatstuderende. "Miljøet og kollegerne på McGill Center for Structural Biology er vigtige for vores laboratoriers fortsatte succes."
Fremtidige konsekvenser for terapeutisk design
Resultaterne kan have konsekvenser for produktionen af nye antibiotika og terapeutika på lang sigt. Siden de først blev opdaget, forskere har været begejstrede for muligheden for at bioingeniør NRPS'er ved at blande og matche arbejdsstationer for at producere designerforbindelser. "Vores undersøgelse viser, at det burde være muligt at mixe og matche disse moduler, men at de biokonstruerede NRPS'er skal modificeres på de punkter, der er involveret i at overføre forbindelsen fra et modul til det næste for at få dem til at fungere godt, " forklarer Dr. Schmeing. "Dette er noget, vi gik sammen med Martin Weigt fra Sorbonne for at gøre som et principbevis i avisen, men som skal optimeres til produktion af designerterapi."
"Strukturer af en dimodulær ikke-ribosomal peptidsyntetase afslører konformationel fleksibilitet, " af Reimer, J.M., Eivaskhani, M, Harb, JEG., Guarne, EN, vægt, M., Schmeing, T. M. blev offentliggjort i tidsskriftet Videnskab .
Sidste artikelEn billigere måde at opskalere atomlagsaflejring på
Næste artikelCRISPR:Mere end blot til genredigering?
 Varme artikler
Varme artikler
-
 Fødevareforskere sigter mod at gøre plantebaseret protein smagere og sundereDavid Julian McClements er en fremtrædende professor i fødevarevidenskab ved UMass Amherst. Kredit:UMass Amherst I takt med at kødspisningen fortsætter med at stige rundt om i verden, fødevarefors
Fødevareforskere sigter mod at gøre plantebaseret protein smagere og sundereDavid Julian McClements er en fremtrædende professor i fødevarevidenskab ved UMass Amherst. Kredit:UMass Amherst I takt med at kødspisningen fortsætter med at stige rundt om i verden, fødevarefors -
 Selvdrevne papirbaserede SPED'er kan føre til nye medicinsk-diagnostiske værktøjerNy papirbaseret diagnostisk enhed detekterer biomarkører og identificerer sygdomme ved at udføre elektrokemiske analyser, og analyserne skifter farve for at indikere specifikke testresultater. Enheden
Selvdrevne papirbaserede SPED'er kan føre til nye medicinsk-diagnostiske værktøjerNy papirbaseret diagnostisk enhed detekterer biomarkører og identificerer sygdomme ved at udføre elektrokemiske analyser, og analyserne skifter farve for at indikere specifikke testresultater. Enheden -
 Et enkelt og universelt design til brændselscelleelektrolytDesign og syntese af POPer og sulfonerede POPer (S-POPer). Kredit:JAIST Forskere ved Japan Advanced Institute of Science and Technology (JAIST) og Dalian Institute of Chemical Physics, det kinesis
Et enkelt og universelt design til brændselscelleelektrolytDesign og syntese af POPer og sulfonerede POPer (S-POPer). Kredit:JAIST Forskere ved Japan Advanced Institute of Science and Technology (JAIST) og Dalian Institute of Chemical Physics, det kinesis -
 Ser lyset:Forskere tilbyder løsning på effektivitetsproblemet ved kunstig fotosynteseFotoelektrokemisk vandopdeling ved hjælp af flux-dyrket fotoanode til effektivt at omdanne solenergi og vand til brintbrændstof. Kredit:Katsuya Teshima Ph.D., direktør for Center for Energi og Miljøvi
Ser lyset:Forskere tilbyder løsning på effektivitetsproblemet ved kunstig fotosynteseFotoelektrokemisk vandopdeling ved hjælp af flux-dyrket fotoanode til effektivt at omdanne solenergi og vand til brintbrændstof. Kredit:Katsuya Teshima Ph.D., direktør for Center for Energi og Miljøvi
- Smart bandage registrerer, kunne forhindre infektioner
- En dag i NASAs Voyagers liv
- Uber introducerer Express Pool service, der lyder lidt som en bus
- Interstellar besøgende formet som kæmpe ildslukker (Opdatering)
- Forskere opdager vejen til forbedret bygkvalitet
- Hvad er graden forskellen mellem Celsius vs Fahrenheit?


