Hvad er enhed for varmeaktion?
1. Enthalpy Change (ΔH): Dette er den mest almindelige måde at udtrykke varmereaktion på. Det repræsenterer mængden af varme, der er absorberet eller frigivet under en reaktion ved konstant tryk.
* enheder:
* joules (j) eller Kilojoules (KJ) er standard SI -enheder til energi, inklusive varme.
* kalorier (cal) eller kilokalorier (kcal) bruges undertiden, især inden for felter som ernæring.
2. Varmekapacitet (c): Dette måler den mængde varme, der kræves for at hæve temperaturen på et stof med et bestemt beløb.
* enheder:
* joules pr. Kelvin (j/k) eller joules pr. grad Celsius (J/° C) til specifik varmekapacitet.
* joules pr. mol kelvin (j/mol · k) eller joules pr. mol grad celsius (j/mol · ° C) Til molær varmekapacitet.
3. Varmestrøm (Q): Dette repræsenterer mængden af varme, der overføres under en proces.
* enheder: Samme som entalpiændring (J eller KJ).
Vigtige overvejelser:
* Tegn: En negativ ΔH indikerer en eksoterm reaktion (varme frigøres). En positiv ΔH indikerer en endoterm reaktion (varme absorberes).
* støkiometri: Entalpiændringer rapporteres normalt pr. Mol reaktion som skrevet. For eksempel betyder ΔH =-500 kJ/mol, at 500 kJ varme frigøres, når 1 mol af reaktionen forekommer.
* kontekst: Vær altid opmærksom på den kontekst og specifikke definition, der bruges, når du arbejder med varmeaktioner.
Fortæl mig, hvis du har en bestemt type varmeaktion i tankerne, og jeg kan give et mere specifikt svar.
Sidste artikelHvad er 135000 pund i metiske tons?
Næste artikelHvad er SI -sfæricitetsenheden?
 Varme artikler
Varme artikler
-
 Cellulose til fremstilling af avancerede materialerErlantz Lizundia – Fernandez. Kredit:UPV/EHU. Det sidste årti har oplevet en stigning i videnskabelige publikationer og patenter på cellulose, den mest almindelige naturlige polymer. Ved at gennem
Cellulose til fremstilling af avancerede materialerErlantz Lizundia – Fernandez. Kredit:UPV/EHU. Det sidste årti har oplevet en stigning i videnskabelige publikationer og patenter på cellulose, den mest almindelige naturlige polymer. Ved at gennem -
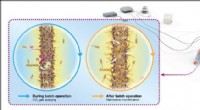 Multifunktionelle porøse ledende membraner hjælper mikrober med at spise sig frem til en hurtigere…Illustration af den mikrobielle elektrosynteseproces, hvorved levende mikrober omdanner kuldioxid til nyttige kemikalier i en elektrokemisk celle via en reduktionsreaktion under påført spænding. Kredi
Multifunktionelle porøse ledende membraner hjælper mikrober med at spise sig frem til en hurtigere…Illustration af den mikrobielle elektrosynteseproces, hvorved levende mikrober omdanner kuldioxid til nyttige kemikalier i en elektrokemisk celle via en reduktionsreaktion under påført spænding. Kredi -
 Forskere skaber ultraletvægts keramisk materiale, der modstår ekstreme temperaturerEt optisk billede, der viser en hBNAG-prøve hvilende på støvdrageren af en blomst. Kredit:X. Xu og X. Duan UCLA-forskere og samarbejdspartnere ved otte andre forskningsinstitutioner har skabt et
Forskere skaber ultraletvægts keramisk materiale, der modstår ekstreme temperaturerEt optisk billede, der viser en hBNAG-prøve hvilende på støvdrageren af en blomst. Kredit:X. Xu og X. Duan UCLA-forskere og samarbejdspartnere ved otte andre forskningsinstitutioner har skabt et -
 Ny krystalteknisk strategi til at designe ultralyse fluorescerende faste farvestofferNår det kommer til at designe ultralyse solid-state fluorescerende materialer, kan brobyggede krystaldesign være nøglen til at muliggøre monomer emission og få adgang til nye krystallinske systemer, a
Ny krystalteknisk strategi til at designe ultralyse fluorescerende faste farvestofferNår det kommer til at designe ultralyse solid-state fluorescerende materialer, kan brobyggede krystaldesign være nøglen til at muliggøre monomer emission og få adgang til nye krystallinske systemer, a
- En CubeSat vil teste vand som et fremdriftssystem
- Hvorfor noget plastikemballage er nødvendigt for at forhindre madspild og beskytte miljøet
- Hvordan påvirkede opdagelsen af glas folks liv?
- Hvordan kan ledere skabe tillid, når informationen bliver ved med at ændre sig?
- Lavpris grafen-jern-filtre, der selektivt adskiller gasblandinger
- En DNA -nanorobot er programmeret til at opfange og sortere molekyler i foruddefinerede områder


