Hvordan kan en flammetest bruges til at identificere atomer?
Princippet:
* ophidsede elektroner: Når et atom opvarmes i en flamme, absorberer dens elektroner energi og springer til højere energiniveau. Dette kaldes excitation.
* vender tilbage til jordtilstand: Spændte elektroner er ustabile og vender hurtigt tilbage til deres originale, lavere energiniveau (jordtilstand).
* Emission af lys: Når elektronerne falder tilbage til deres jordtilstand, frigiver de den absorberede energi som lys. Farven på dette udsendte lys er karakteristisk for det specifikke element.
hvordan man udfører en flammetest:
1. prøveforberedelse: En lille prøve af det ukendte stof fremstilles, ofte ved at opløse det i et opløsningsmiddel eller dyppe en trådsløjfe i det.
2. Opvarmning af prøven: Prøven holdes derefter i en Bunsen -brænderflamme og opvarmer den til en høj temperatur.
3. observation af farven: Farven på flammen observeres omhyggeligt og sammenlignes med kendte flammetestfarver.
Eksempler på flammetestfarver:
* natrium (NA): Intens gul
* kalium (k): Lilac/Violet
* calcium (CA): Orange-rød
* barium (BA): Grøn
* kobber (CU): Blågrøn
* lithium (Li): Crimson Red
Begrænsninger af flammetest:
* Ikke alle elementer: Ikke alle elementer producerer en tydelig flammefarve. Nogle elementer har farver, der er vanskelige at skelne eller er meget svage.
* interferenser: Tilstedeværelsen af andre elementer kan undertiden maske eller ændre flammefarven.
* ikke kvantitativ: Flame -tests kan kun bruges til kvalitativ analyse, hvilket betyder, at de fortæller dig, hvilket element der er til stede, men ikke hvor meget af det.
Kortfattet:
Flammetests er et værdifuldt værktøj til at identificere visse elementer baseret på de unikke farver, de udsender, når de opvarmes. Selvom den ikke er perfekt, kan denne enkle teknik give værdifulde ledetråde til bestemmelse af sammensætningen af et ukendt stof.
Sidste artikelHvilken ordligning opsummerer hydrolysen af en lipid?
Næste artikelHvilket stof ændrer sig, når de udsættes for luften?
 Varme artikler
Varme artikler
-
 Nye fremskridt for at reducere defekter i multimaterialer ved hjælp af rettet energiaflejringIfølge undersøgelsen kan manipulation af gradientforholdet mellem komponentmaterialerne under rettet energiaflejring (en 3D-printteknik) føre til højtydende funktionelle materialer med minimale defekt
Nye fremskridt for at reducere defekter i multimaterialer ved hjælp af rettet energiaflejringIfølge undersøgelsen kan manipulation af gradientforholdet mellem komponentmaterialerne under rettet energiaflejring (en 3D-printteknik) føre til højtydende funktionelle materialer med minimale defekt -
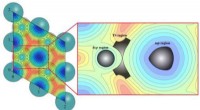 Nøjagtig og effektiv dynamisk beregningsstrategi for heterogen katalyseKredit:Prof. Zhuangs gruppe Teoretisk beregning er blevet en uundværlig tilgang til at afsløre termodynamikken og kinetikken i katalyse. Statisk beregningsstrategi er den mest populære tilgang i te
Nøjagtig og effektiv dynamisk beregningsstrategi for heterogen katalyseKredit:Prof. Zhuangs gruppe Teoretisk beregning er blevet en uundværlig tilgang til at afsløre termodynamikken og kinetikken i katalyse. Statisk beregningsstrategi er den mest populære tilgang i te -
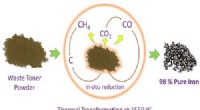 Træk jern ud af spildprintertonerKredit:American Chemical Society En skønne dag, rester af toner i kasserede printerpatroner kan have et nyt liv som bro eller bygningsdele i stedet for som skraldespand, spilde væk på lossepladser
Træk jern ud af spildprintertonerKredit:American Chemical Society En skønne dag, rester af toner i kasserede printerpatroner kan have et nyt liv som bro eller bygningsdele i stedet for som skraldespand, spilde væk på lossepladser -
 Ferrofluid overfladesimuleringer går mere end huden dybtFerrofluids magnetiske reaktioner kan modelleres til at udvide deres anvendelse inden for en bredere vifte af områder som avanceret elektronik og nanomedicin. Kredit:KAUST Computermodeller simuler
Ferrofluid overfladesimuleringer går mere end huden dybtFerrofluids magnetiske reaktioner kan modelleres til at udvide deres anvendelse inden for en bredere vifte af områder som avanceret elektronik og nanomedicin. Kredit:KAUST Computermodeller simuler
- Mat lokkemad, kroger og ødelægger forurenende stoffer i vand
- Kriminelle cybersquatters
- Siger mod at forbedre fælles forbindelsesteknologier til letvægts- og højstyrkestrukturer
- Forskere udforsker, hvordan antarktiske iskapper vil reagere på klimaændringer og global havniveau…
- Fremtidens robotter:mere R2D2 end C3PO
- Hvilke partikler har mere kinetisk energi - dem i et stof med høj eller lav temperatur?


