Hvordan kan du adskille en blanding, der indeholder ti opløseligt salt i opløsning?
1. Forståelse af salte:
* Identificer kationerne og anionerne: Du skal kende de specifikke kemiske formler for hvert salt for at forstå de ioner, der er til stede i blandingen.
* opløselighedsegenskaber: Undersøg opløseligheden af hvert salt i forskellige opløsningsmidler (vand, alkohol osv.) Ved forskellige temperaturer. Nogle salte er muligvis selektivt opløselige i specifikke opløsningsmidler.
2. Teknikker til adskillelse:
* fraktioneret krystallisation: Hvis salte har betydeligt forskellige opløseligheder, kan du udnytte denne forskel for at adskille dem.
* proces:
1. fordamp langsomt opløsningsmidlet (normalt vand), mens den opretholder en kontrolleret temperatur.
2. Det mindst opløselige salt begynder først at krystallisere.
3. Fjern krystaller forsigtigt og gentag processen for at adskille andre salte.
* Selektiv nedbør: Hvis du kan udnytte forskelle i dannelsen af uopløselige forbindelser, kan du selektivt udfælde specifikke salte.
* proces:
1. Tilføj et reagens, der reagerer med en af kationerne for at danne et uopløseligt bundfald.
2. Filtrer bundfaldet ud, hvilket efterlader de resterende salte i opløsning.
3. Gentag denne proces med forskellige reagenser for at udfælde andre salte.
* ionudvekslingskromatografi: Denne teknik bruger en harpiks med specifikke funktionelle grupper til at adskille ioner baseret på deres ladning og affinitet til harpiksen.
* proces:
1. Pass opløsningen gennem en søjle pakket med en ionbytterharpiks.
2. Forskellige ioner vil binde til harpiksen i forskellige hastigheder baseret på deres opladning og affinitet.
3. Eluér ioner fra harpiksen med et specifikt opløsningsmiddel- eller pH -gradient.
* elektrolyse: Hvis salte indeholder metaller med forskellige reduktionspotentialer, kan du bruge elektrolyse til selektivt at deponere dem på elektroder.
* spektroskopiske teknikker: Teknikker som NMR, IR og UV-VIS-spektroskopi kan bruges til at identificere og kvantificere de forskellige salte, der er til stede i blandingen.
3. Kombination af teknikker:
Det er sandsynligt, at du bliver nødt til at kombinere flere af disse teknikker for at opnå en komplet adskillelse af de ti opløselige salte.
Vigtige overvejelser:
* Renhed af de adskilte salte: Komplet adskillelse er ofte vanskelig at opnå, og du kan ende med en vis grad af forurening.
* Udbytte: Du er muligvis ikke i stand til at gendanne alle de originale salte på grund af tab under adskillelsesprocessen.
* sikkerhed: Brug altid passende personligt beskyttelsesudstyr (PPE) og følg ordentlige laboratoriesikkerhedsprocedurer, når du arbejder med kemikalier.
Eksempel:
Forestil dig en blanding, der indeholder NaCl, KCL og MGCL2. Du kan bruge fraktioneret krystallisation til først at adskille NaCl, da den har den laveste opløselighed, efterfulgt af KCL. Derefter ville tilsætning af NaOH udfælde Mg (OH) 2 og efterlade den resterende saltopløsning.
Konklusion:
At adskille en blanding af ti opløselige salte er en kompleks proces, der kræver omhyggelig planlægning og udførelse. De anvendte specifikke teknikker afhænger af saltens art og det ønskede adskillelsesniveau.
Sidste artikelHvilken fase falder den nukleare membran?
Næste artikelHvad er navnet på kemiske budbringere?
 Varme artikler
Varme artikler
-
 Syntetiske brændstoffer kan mindske CO2-fodaftrykketKredit:CC0 Public Domain Syntetiske brændstoffer, lavet ved hjælp af kulstof fanget fra luften, landbrugsaffald eller biomasse, kunne hjælpe transportsektoren med at reducere sin afhængighed af fo
Syntetiske brændstoffer kan mindske CO2-fodaftrykketKredit:CC0 Public Domain Syntetiske brændstoffer, lavet ved hjælp af kulstof fanget fra luften, landbrugsaffald eller biomasse, kunne hjælpe transportsektoren med at reducere sin afhængighed af fo -
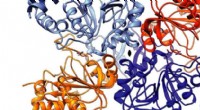 Forskere nedbryder tuberkulosestrukturenKrystalstruktur af det nyligt afbildede enzym med carbonring, der spalter fra tuberkulosebakterien, IpdABMtb. Kredit:Lindsay Eltis Forskere fra University of British Columbia har taget et afgørend
Forskere nedbryder tuberkulosestrukturenKrystalstruktur af det nyligt afbildede enzym med carbonring, der spalter fra tuberkulosebakterien, IpdABMtb. Kredit:Lindsay Eltis Forskere fra University of British Columbia har taget et afgørend -
 Udstiller moderne falsknereRobert Trotter smedede Sarah Honns billede af 1866 først i anden halvdel af det 20. århundrede. Kredit:James Hamm, Buffalo State College, State University of New York, Bøffel, NY Kunstmarkedet boo
Udstiller moderne falsknereRobert Trotter smedede Sarah Honns billede af 1866 først i anden halvdel af det 20. århundrede. Kredit:James Hamm, Buffalo State College, State University of New York, Bøffel, NY Kunstmarkedet boo -
 iPhone plus porøst silicium i nanoskala er lig med billig, simpel hjemmediagnostikSiliciumchips svarende til dem, der ville blive brugt i detektionsprocessen. Kredit:Vanderbilt University/Heidi Hall De enkleste medicinske hjemmetests kan ligne et dæk af forskellige siliciumchip
iPhone plus porøst silicium i nanoskala er lig med billig, simpel hjemmediagnostikSiliciumchips svarende til dem, der ville blive brugt i detektionsprocessen. Kredit:Vanderbilt University/Heidi Hall De enkleste medicinske hjemmetests kan ligne et dæk af forskellige siliciumchip
- Babytrin:Forskeres nye bog undersøger spædbørns rolle i moderniseringen af det amerikanske samf…
- Fra havvand til ferskvand med et nanoteknologisk filter
- Hvilket videnskabsområde fokuserede Sirissac Newton på?
- Skulptur af en konjugeret polymer ved hjælp af DNA-origami
- Hvorfor siger vi, at der er udført et joule arbejde en kraft på en genstand..?
- Hvilken del af afbalanceret kemisk ligning giver information om de relative tal mol -reaktanter og p…


