Hvilken del af afbalanceret kemisk ligning giver information om de relative tal mol -reaktanter og produkter involverer i en reaktion?
Her er hvorfor:
* støkiometri: Undersøgelsen af de kvantitative forhold mellem reaktanter og produkter i kemiske reaktioner.
* Koefficienter: Tallene skrevet foran hver kemisk formel i en afbalanceret ligning.
* mol: En måleenhed, der repræsenterer et specifikt antal partikler (6,022 x 10 23 ).
Eksempel:
Den afbalancerede ligning for forbrænding af metan er:
Ch 4 + 2o 2 → Co 2 + 2H 2 O
* Koefficienter: 1, 2, 1, 2
* Fortolkning: Denne ligning fortæller os, at:
* 1 mol metan (CH 4 ) reagerer med 2 mol ilt (O 2 )
* At producere 1 mol kuldioxid (CO 2 ) og 2 mol vand (H 2 O)
Nøglepunkter:
* Koefficienterne repræsenterer det * relative * antal mol, ikke de faktiske mængder, der bruges i en bestemt reaktion.
* Afbalancering af en kemisk ligning sikrer, at antallet af atomer i hvert element er det samme på begge sider, hvilket tilfredsstiller loven om bevarelse af masse.
Ved at forstå de støkiometriske koefficienter kan vi forudsige mængden af reaktanter og produkter, der er involveret i en reaktion, som er afgørende for at udføre kemiske reaktioner og beregninger.
Sidste artikelHvilke subatomære partikler har en afgift?
Næste artikelHvad er den kemiske ligning for lactose?
 Varme artikler
Varme artikler
-
 Forskere registrerer greenlight gasdetektering ved stuetemperaturSkyder. Kredit:MIPT Russiske forskere har udviklet en mekanisme til at detektere molekylært brint ved hjælp af grønt lys til at belyse en nanokrystallinsk sammensat sensor baseret på zink og indiu
Forskere registrerer greenlight gasdetektering ved stuetemperaturSkyder. Kredit:MIPT Russiske forskere har udviklet en mekanisme til at detektere molekylært brint ved hjælp af grønt lys til at belyse en nanokrystallinsk sammensat sensor baseret på zink og indiu -
 Hår finder nye rødder som vækstmedium for urban farmingGrafisk abstrakt. Kredit:ACS Sustainable Chemistry &Engineering (2022). DOI:10.1021/acssuschemeng.2c01668 Klumperne af kasseret hår på salongulvet kan en dag hjælpe med at dyrke din frokostsalat, t
Hår finder nye rødder som vækstmedium for urban farmingGrafisk abstrakt. Kredit:ACS Sustainable Chemistry &Engineering (2022). DOI:10.1021/acssuschemeng.2c01668 Klumperne af kasseret hår på salongulvet kan en dag hjælpe med at dyrke din frokostsalat, t -
 Selv maskiner har brug for deres greensKredit:CC0 Public Domain Et træ vokser sig stærkt efter år med at generere sin egen mad. Forestil dig nu, om produkter kunne styrkes med de samme levende materialer, der giver næringsstoffer til a
Selv maskiner har brug for deres greensKredit:CC0 Public Domain Et træ vokser sig stærkt efter år med at generere sin egen mad. Forestil dig nu, om produkter kunne styrkes med de samme levende materialer, der giver næringsstoffer til a -
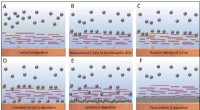 At overvinde et batteris fatale fejlSkema af litumaflejringsmekanisme i tilfælde af grafenoxid-modificerede prøver. A-F) Adsorption af Li-ioner til den lithiofile GOn-belægning og kontrolleret levering på stedet af Li-ioner til metalove
At overvinde et batteris fatale fejlSkema af litumaflejringsmekanisme i tilfælde af grafenoxid-modificerede prøver. A-F) Adsorption af Li-ioner til den lithiofile GOn-belægning og kontrolleret levering på stedet af Li-ioner til metalove
- Undersøgelse:Dødeligt plastaffald er nu almindeligt i græske hvaler
- Forretningen blomstrer for plastgiganter, når forandringen lokker
- Forskere kaster nyt lys over påvisning af influenza
- Forekommer metaboliske reaktioner isoleret?
- Skænding om kød, finde trøst med venner:De store abers følelser
- Forskere finder algoritmer til storskala hjernesimuleringer


