I enkeltudskiftende reaktioner er metaller lavere på aktivitetsdiagrammet højere et sandt for falsk?
Her er hvorfor:
* Aktivitetsserie: Aktivitetsserien af metaller (undertiden kaldet reaktivitetsserien) rangerer metaller baseret på deres tendens til at miste elektroner og danne positive ioner.
* Enkeltudskiftningsreaktioner: I en enkelt erstatningsreaktion vil et mere reaktivt metal fortrænge et mindre reaktivt metal fra en forbindelse.
* højere på aktivitetsserien =mere reaktiv: Metaller, der er højere på aktivitetsserien, er mere reaktive, hvilket betyder, at de er mere tilbøjelige til at fortrænge metaller lavere på serien.
Eksempel:
Overvej reaktionen af zink (Zn) med kobbersulfat (cuso₄):
Zn (s) + cuso₄ (aq) → Znso₄ (aq) + cu (s)
Zink er højere på aktivitetsserien end kobber. Derfor er zink mere reaktiv og fortrænger kobber fra kobbersulfatopløsningen.
Kortfattet: Metaller Højere På aktivitetskortet skal du erstatte metaller lavere på diagrammet i enkeltstatningsreaktioner.
 Varme artikler
Varme artikler
-
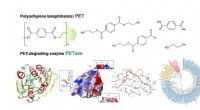 Strukturel indsigt i den molekylære mekanisme ved PET -nedbrydningStrukturel indsigt i den molekylære mekanisme ved poly (ethylenterephthalat) nedbrydning og det fylogenetiske træ af mulige PET -nedbrydende enzymer. Kredit:KAIST Et KAIST metabolisk ingeniørunder
Strukturel indsigt i den molekylære mekanisme ved PET -nedbrydningStrukturel indsigt i den molekylære mekanisme ved poly (ethylenterephthalat) nedbrydning og det fylogenetiske træ af mulige PET -nedbrydende enzymer. Kredit:KAIST Et KAIST metabolisk ingeniørunder -
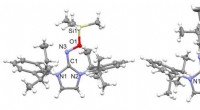 Fange radikale molekyler, før de forsvinderKrystalstruktur af to af de fire radikale kationer syntetiseret i undersøgelsen. Kernen (oxim) er stabiliseret med en ringformet struktur (NHC), og resten af molekylet viser let ekspansion. Den mole
Fange radikale molekyler, før de forsvinderKrystalstruktur af to af de fire radikale kationer syntetiseret i undersøgelsen. Kernen (oxim) er stabiliseret med en ringformet struktur (NHC), og resten af molekylet viser let ekspansion. Den mole -
 Nyt open source-websted indeholder tegninger til lab-on-a-chip-enhederMetafludics.org, et nyt MIT open source-websted, leverer tegninger til mikrofluidiske dele. På billedet er et par billeder fra hjemmesiden. Kredit:Metafludics.org Et nyt MIT-designet open source-w
Nyt open source-websted indeholder tegninger til lab-on-a-chip-enhederMetafludics.org, et nyt MIT open source-websted, leverer tegninger til mikrofluidiske dele. På billedet er et par billeder fra hjemmesiden. Kredit:Metafludics.org Et nyt MIT-designet open source-w -
 Kemikalieproducenter er imod nye tarifferKredit:CC0 Public Domain I juni, kemiske producenter konvergerede om Washington, D.C., at opfordre US Trade Representative Office (USTR) til at fjerne visse kemikalier fra en ny liste over toldsat
Kemikalieproducenter er imod nye tarifferKredit:CC0 Public Domain I juni, kemiske producenter konvergerede om Washington, D.C., at opfordre US Trade Representative Office (USTR) til at fjerne visse kemikalier fra en ny liste over toldsat
- Laserdiode registrerer forfalsket olivenolie
- Hvad gør Kina for at skabe et grønt OL?
- Nye modeller beskriver, hvordan store floder vil reagere på skiftende miljøforhold
- Sådan konverteres hestekræfter til fod pounds
- Hvordan bruges DNA til at hjælpe med at klassificere organismer?
- Hvilket beskriver bedst breddegrad?


