Hvilket volumen på 1,336 m NaOH ville være påkrævet for at titrere 47,2 ml 2,075 H2SO4?
1. Skriv den afbalancerede kemiske ligning:
2 NaOH (aq) + h₂so₄ (aq) → na₂so₄ (aq) + 2 h₂o (l)
2. Bestem molen på H₂so₄:
* Konverter mængden af H₂so₄ fra Ml til L:47,2 ml * (1 L / 1000 ml) =0,0472 L
* Multiplicer lydstyrken med molariteten for at finde molerne:0,0472 L * 2,075 mol/l =0,0979 mol H₂so₄
3. Brug molforholdet fra den afbalancerede ligning til at finde mol af NaOH:
* Molforholdet mellem NaOH og H₂so₄ er 2:1.
* Mol NaOH =0,0979 mol H₂so₄ * (2 mol NaOH / 1 mol H₂so₄) =0,1958 mol NaOH
4. Beregn mængden af NaOH -løsning:
* Del molen af NaOH med molariteten af NaOH -opløsningen:0,1958 mol NaOH / 1,336 mol / L =0,1465 L NaOH
5. Konverter lydstyrken til ML:
* 0,1465 L * (1000 ml / 1 l) =146,5 ml
Derfor har du brug for 146,5 ml 1,336 m NaOH -opløsning for at titrere 47,2 ml 2,075 m H₂so₄.
Sidste artikelKan metalpladerne i en elektrokemisk celle være lavet af samme metal?
Næste artikelHvorfor bruge isobutan i deodorant?
 Varme artikler
Varme artikler
-
 Syntese af UV-absorbere fra cashewnøddeskalvæskeForskere fra Mainz og Johannesburg med en prøve af udgangsmaterialet til UV-absorber fra cashewnøddeskalvæske. Kredit:Opatz Lab Forskere ved Johannes Gutenberg University Mainz (JGU) i Tyskland, i
Syntese af UV-absorbere fra cashewnøddeskalvæskeForskere fra Mainz og Johannesburg med en prøve af udgangsmaterialet til UV-absorber fra cashewnøddeskalvæske. Kredit:Opatz Lab Forskere ved Johannes Gutenberg University Mainz (JGU) i Tyskland, i -
 Første nogensinde atomopløsningsvideo af saltkrystaller, der dannes i realtidEn natriumchlorid krystal, der vokser i et vibrerende kulstof nanohorn. Kredit:© 2021 American Chemical Society To nye teknikker, atomopløsning i realtid video og konisk carbon nanorør indeslutnin
Første nogensinde atomopløsningsvideo af saltkrystaller, der dannes i realtidEn natriumchlorid krystal, der vokser i et vibrerende kulstof nanohorn. Kredit:© 2021 American Chemical Society To nye teknikker, atomopløsning i realtid video og konisk carbon nanorør indeslutnin -
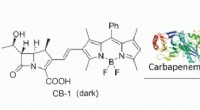 En fluorogen probe kan detektere aktiviteten af multidrug-resistente patogener i et assaysystemKredit:Wiley Carbapenemer er blandt sidste udvejs antibiotika og kan bekæmpe infektioner, hvor andre lægemidler længe har mistet deres effektivitet. Imidlertid, selv carbapenem-resistente patogene
En fluorogen probe kan detektere aktiviteten af multidrug-resistente patogener i et assaysystemKredit:Wiley Carbapenemer er blandt sidste udvejs antibiotika og kan bekæmpe infektioner, hvor andre lægemidler længe har mistet deres effektivitet. Imidlertid, selv carbapenem-resistente patogene -
 Små molekylære bevægelser kan føre til mere effektive biobrændselscellerKredit:Leiden Universitet Leiden-forskere har fundet små bevægelser i laccase-enzymet. Denne opdagelse kan føre til udviklingen af meget mere effektive biobrændselsceller. Udgivelse i Biofysisk
Små molekylære bevægelser kan føre til mere effektive biobrændselscellerKredit:Leiden Universitet Leiden-forskere har fundet små bevægelser i laccase-enzymet. Denne opdagelse kan føre til udviklingen af meget mere effektive biobrændselsceller. Udgivelse i Biofysisk
- Excretory System Science Project Idéer
- Hvad repræsenterer de tættere områder af en elektronsky?
- Super-Jordens exoplanet i kredsløb om nærliggende stjerne opdaget
- Hvad er osmolariteten af en 0,2M opløsning KCL?
- En bedre forståelse af, hvordan cirrusskyer dannes
- Hvad er beregningerne af hjul teodorus?


