Hvad sker der med fasegrænsen for vand ved 1 atm?
Triple Point:
* Ved en bestemt temperatur og tryk kan der eksistere vand i alle tre faser samtidigt. Dette kaldes tredobbeltpunktet, og for vand forekommer det ved 0,01 ° C (32,018 ° F) og 0,006 atm. Dette er en meget specifik betingelse og er ikke relevant for hverdagens 1 ATM -tryk.
Normale frysnings- og kogepunkter:
* Ved 1 atm er det normale frysepunkt for vand 0 ° C (32 ° F) , som er den temperatur, hvormed flydende vand overgår til fast is.
* Ved 1 atm er det normale kogepunkt af vand 100 ° C (212 ° F) , som er den temperatur, hvormed flydende vand overgår til vanddamp.
faseændringer ved 1 atm:
* under 0 ° C (32 ° F): Der findes vand som massiv is.
* mellem 0 ° C (32 ° F) og 100 ° C (212 ° F): Der findes vand som flydende vand.
* over 100 ° C (212 ° F): Der findes vand som vanddamp.
Bemærk: Dette er de typiske værdier for rent vand. Urenheder, opløste stoffer og andre faktorer kan skifte fryse- og kogepunkter lidt.
I det væsentlige, ved 1 atm, definerer fasegrænsen for vand de temperaturer, hvorpå den overgår fra fast til væske (0 ° C) og væske til gas (100 ° C).
Sidste artikelHvorfor er metalstykket ikke smeltet sammen i slaggen?
Næste artikelHvad er et ikke-polyhedra solidt?
 Varme artikler
Varme artikler
-
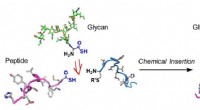 En vindende kombination til glykoproteinsynteseGlycoproteinsyntese ved kemisk indsættelse ved hjælp af en thiosyremedieret strategi:Metoden samler et fuldt glycoproteinsegment i to trin. Kredit:Osaka University Mange processer i kroppen regule
En vindende kombination til glykoproteinsynteseGlycoproteinsyntese ved kemisk indsættelse ved hjælp af en thiosyremedieret strategi:Metoden samler et fuldt glycoproteinsegment i to trin. Kredit:Osaka University Mange processer i kroppen regule -
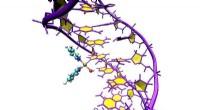 Hvordan interagerer metaller med DNA?Computersimuleringer viser den præcise placering af Pt103 i DNA. Kredit:Juan J. Nogueira, Universitetet i Wien I et par årtier, metalholdige lægemidler er med succes blevet brugt til at bekæmpe vi
Hvordan interagerer metaller med DNA?Computersimuleringer viser den præcise placering af Pt103 i DNA. Kredit:Juan J. Nogueira, Universitetet i Wien I et par årtier, metalholdige lægemidler er med succes blevet brugt til at bekæmpe vi -
 Forskere kaster nyt lys over mysterier bag lysudsendelsen fra ildfluerEn hunbille glødende grøn-gult lys. Kredit:NYU Abu Dhabi Et team af forskere fra NYU Abu Dhabis (NYUAD) Smart Materials Lab (SML) ledet af professor i kemi Panče Naumov har gennemført en grundig g
Forskere kaster nyt lys over mysterier bag lysudsendelsen fra ildfluerEn hunbille glødende grøn-gult lys. Kredit:NYU Abu Dhabi Et team af forskere fra NYU Abu Dhabis (NYUAD) Smart Materials Lab (SML) ledet af professor i kemi Panče Naumov har gennemført en grundig g -
 Cu-Fe-katalysator letter omgivelsestrykkonvertering af CO2 til langkædede olefinerStrukturelle karakteriseringer af aktiveret CuFeO2 . et HAADF-billede af aktiveret CuFeO2 . b XRD-profiler for aktiveret CuFeO2 . c Mössbauer-spektre af aktiveret CuFeO2 2. d Cu LMM Auger, e Fe2p XPS
Cu-Fe-katalysator letter omgivelsestrykkonvertering af CO2 til langkædede olefinerStrukturelle karakteriseringer af aktiveret CuFeO2 . et HAADF-billede af aktiveret CuFeO2 . b XRD-profiler for aktiveret CuFeO2 . c Mössbauer-spektre af aktiveret CuFeO2 2. d Cu LMM Auger, e Fe2p XPS
- Forskere udvikler papirbaserede arrays med høj kapacitet af 3D-tumormodeller
- Fredagsessay:hvorfor voksne stadig har brug for eventyr
- Er den videnskabelige metode en tilfældig tilgang, som forskere bruger i problemløsning?
- Kirurger forudsiger fremtiden for nanomedicin i praksis
- Bordeauxs storslåede tabte årgang skubber små avlere til kanten
- Hvilket rige af organismer er det mest komplekse, og hvorfor?


