Hvorfor ædle gasser er monoatomiske i den periodiske tabel?
* stabil elektronkonfiguration: Noble gasser har en fuld ydre skal af elektroner, hvilket betyder, at de har det maksimale antal elektroner, som deres yderste energiniveau kan have. Denne konfiguration er utroligt stabil og ureaktiv.
* minimal energi krævet: For at danne en kemisk binding er atomer nødt til at vinde, miste eller dele elektroner. Noble gasser har allerede en stabil konfiguration, så de behøver ikke at interagere med andre atomer for at få stabilitet. Dette gør dem ekstremt ureaktive og forklarer deres eksistens som enkeltatomer.
* svage interatomiske kræfter: De eneste kræfter, der holder ædle gasatomer sammen, er svage van der Waals -styrker. Disse kræfter er meget svagere end de kemiske bindinger, der holder atomer sammen i molekyler.
Kortfattet: Noble gasser er monoatomiske, fordi deres stabile elektronkonfiguration gør dem utroligt ureaktive og forhindrer dem i at danne bindinger med andre atomer.
 Varme artikler
Varme artikler
-
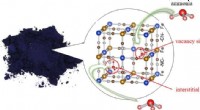 Et blåt pigment viste sig at være et højtydende ammoniakadsorbent(Figur):Preussisk blå (til venstre) og den preussiske blå krystalstruktur, der adsorberer ammoniakmolekyler (til højre). Kredit:Avanceret industriel videnskab og teknologi Akira Takahashi (forsker
Et blåt pigment viste sig at være et højtydende ammoniakadsorbent(Figur):Preussisk blå (til venstre) og den preussiske blå krystalstruktur, der adsorberer ammoniakmolekyler (til højre). Kredit:Avanceret industriel videnskab og teknologi Akira Takahashi (forsker -
 Enzymet nedbryder PET-plastik på rekordtidDr. Christian Sonnendecker og hans team opdagede et enzym, der nedbryder PET-plast med rekordhastighed. Kredit:Leipzig Universitet / Swen Reichhold Plastflasker, punnets, wrap - letvægtsemballage l
Enzymet nedbryder PET-plastik på rekordtidDr. Christian Sonnendecker og hans team opdagede et enzym, der nedbryder PET-plast med rekordhastighed. Kredit:Leipzig Universitet / Swen Reichhold Plastflasker, punnets, wrap - letvægtsemballage l -
 Nye lysdrevne katalysatorer kan hjælpe med fremstillingenMIT-kemikere har designet en ny type fotoredox-katalysator, der kan gøre det nemmere at inkorporere lysdrevne reaktioner i kontinuerlige produktionsprocesser. Polymerkatalysatorerne kunne bruges til a
Nye lysdrevne katalysatorer kan hjælpe med fremstillingenMIT-kemikere har designet en ny type fotoredox-katalysator, der kan gøre det nemmere at inkorporere lysdrevne reaktioner i kontinuerlige produktionsprocesser. Polymerkatalysatorerne kunne bruges til a -
 Video:Hortensia, de mærkelige farveskiftende blomsterKredit:The American Chemical Society Erfarne gartnere ved, at de kan justere farven på hortensiablomster mellem pink og blå ved at ændre jordens pH. Men pH er ikke hele historien. Den kamæleonlig
Video:Hortensia, de mærkelige farveskiftende blomsterKredit:The American Chemical Society Erfarne gartnere ved, at de kan justere farven på hortensiablomster mellem pink og blå ved at ændre jordens pH. Men pH er ikke hele historien. Den kamæleonlig
- At forbinde prikkerne på himlen kunne kaste nyt lys over mørkt stof
- Klimaforsker om FN-rapport:Lige så slemt, som vi forventede
- Bilproducenten Tesla forbliver en offentlig virksomhed, CEO Musk siger
- Hvad er videnskabsindholdsopgørelser?
- Forskere afslører atomaktivitet af grøn katalysator, der anvendes i PVC-produktion
- Evolution fanget på fersk gerning:Forskere måler, hvor hurtigt genomerne ændrer sig


