Hvilke obligationer danner aluminium og kulstof?
Her er en sammenbrud:
* kovalente obligationer: I aluminiumscarbid deler carbonatomer elektroner med aluminiumatomer og danner stærke kovalente bindinger. Dette resulterer i en meget stabil forbindelse.
* ioniske bindinger: Selvom det ikke er den primære bindingstype, er der en vis grad af ionisk karakter på grund af elektronegativitetsforskellen mellem aluminium og kulstof. Carbonatomerne er lidt negativt ladet, mens aluminiumatomerne er lidt positivt ladet.
aluminiumskarbid er et krystallinsk fast stof, der bruges i flere applikationer, herunder:
* Produktion af metan: AL4C3 reagerer med vand for at producere metangas, hvilket er et vigtigt brændstof og råstof.
* keramik: Aluminiumskarbid bruges som en forstærkning i keramiske materialer for at forbedre deres hårdhed og styrke.
* applikationer med høj temperatur: Dets høje smeltepunkt og modstand mod oxidation gør det velegnet til brug i miljøer med høj temperatur.
Andre aluminiumskarbonforbindelser:
* organoaluminumforbindelser: Disse forbindelser indeholder aluminiumatomer, der er direkte bundet til carbonatomer. De bruges ofte som katalysatorer i organisk syntese.
* Aluminiumsholdige polymerer: Nogle polymerer indeholder aluminiumatomer bundet til kulstofkæder, hvilket giver dem særlige egenskaber.
Nøglepunkter:
* Den primære bindingstype mellem aluminium og kulstof i aluminiumskarbid er kovalent .
* Der er en let ionisk karakter på grund af forskelle i elektronegativitet.
* Aluminiumskarbid er en stabil forbindelse med forskellige industrielle anvendelser.
* Der findes andre aluminiumskarbonforbindelser, men de er mindre almindelige end aluminiumskarbid.
Sidste artikelHvor mange milliliter er der i 100 g pulver?
Næste artikelHvorfor ædle gasser er monoatomiske i den periodiske tabel?
 Varme artikler
Varme artikler
-
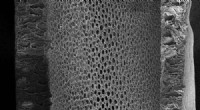 Membraner til industriel separering af kemiske blandingerEn overlegen membran, med en højere poretæthed, fremstilles ved syntetisering af denne polyacrylonitril -nanofiltreringsmembran ved hjælp af et ionisk flydende opløsningsmiddel. Kredit:© 2017 Susana N
Membraner til industriel separering af kemiske blandingerEn overlegen membran, med en højere poretæthed, fremstilles ved syntetisering af denne polyacrylonitril -nanofiltreringsmembran ved hjælp af et ionisk flydende opløsningsmiddel. Kredit:© 2017 Susana N -
 Udvikling af et bredt temperaturområde og højspændingsvandige MXene plane mikro-superkondensatore…(a) Det elektrokemiske stabilitetsvindue for højkoncentreret LiCl-vandig elektrolyt udvider sig til ~ 2,7 V. (b) Spændingsvinduet for MXene-elektrode i højkoncentreret LiCl-vandig elektrolyt udvides t
Udvikling af et bredt temperaturområde og højspændingsvandige MXene plane mikro-superkondensatore…(a) Det elektrokemiske stabilitetsvindue for højkoncentreret LiCl-vandig elektrolyt udvider sig til ~ 2,7 V. (b) Spændingsvinduet for MXene-elektrode i højkoncentreret LiCl-vandig elektrolyt udvides t -
 Stressede kakaotræer kan producere mere smagfuld chokoladeKredit:American Chemical Society De fleste er enige om, at chokolade smager fantastisk, men er der en måde at få det til at smage endnu bedre? Måske, ifølge forskere, der kiggede på forskellige fo
Stressede kakaotræer kan producere mere smagfuld chokoladeKredit:American Chemical Society De fleste er enige om, at chokolade smager fantastisk, men er der en måde at få det til at smage endnu bedre? Måske, ifølge forskere, der kiggede på forskellige fo -
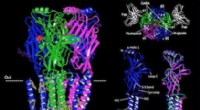 Struktur af større hjernereceptor, der er behandlingsmål for epilepsi, angst løstArkitekturen af GABAA-receptoren. Kredit:UT Southwestern UT Southwestern-forskere har i dag offentliggjort den første atomare struktur af en hjernereceptor bundet til et lægemiddel, der bruges t
Struktur af større hjernereceptor, der er behandlingsmål for epilepsi, angst løstArkitekturen af GABAA-receptoren. Kredit:UT Southwestern UT Southwestern-forskere har i dag offentliggjort den første atomare struktur af en hjernereceptor bundet til et lægemiddel, der bruges t
- Ny forskning baner vejen for simulering af katalysatorer under reaktionsbetingelser
- Evolution er på arbejde inden for computere såvel som biovidenskab
- Hvordan partnervold påvirker afgørelser om forældremyndighed
- Er jorden placeret i spiralarme?
- T-Rex fossil sælges for rekordstore $31,8 mio
- Kinas miljødata:Verdens største forurener i antal


