Hvad er hybridiseringen af orbitaler omkring N atom i HNO2?
1. Tegn Lewis -strukturen:
* nitrogen (n): 5 Valenselektroner
* ilt (O): 6 valenselektroner hver
* brint (H): 1 valenselektron hver
Lewis -strukturen af Hno₂ er:
`` `
O
/ \
N o
\ |
H
`` `
2. Tæl elektrondomænerne:
* Elektrondomæner er områder, hvor elektroner er koncentreret omkring det centrale atom. Dette inkluderer:
* Enkelt obligationer
* Dobbeltobligationer
* Triple Bonds
* Enlige par
Nitrogenatomet har:
* To enkeltbindinger (N-O og N-H)
* En dobbeltbinding (n =O)
* Ingen ensomme par
Derfor har nitrogen i alt 3 elektrondomæner .
3. Bestem hybridiseringen:
* 2 elektrondomæner: SP -hybridisering
* 3 elektrondomæner: SP² hybridisering
* 4 elektrondomæner: SP³ hybridisering
* 5 Elektrondomæner: sp³d hybridisering
* 6 Elektrondomæner: sp³d² hybridisering
Siden nitrogenatomet har 3 elektrondomæner , det er sp² hybridiseret .
Konklusion: Nitrogenatomet i HNO₂ er SP² hybridiseret .
Sidste artikelHvad sker der med molekylerne i en gas, når der påføres tryk?
Næste artikelHvad er de to kritiske faser til dannelsesstadier?
 Varme artikler
Varme artikler
-
 Vulkanformet trend muliggør rationelt design af polysulfidkatalysatorer i lithium-svovlbatterierSkematisk diagram af designprincipper for højeffektive lithium-svovl-katalysatorer. Kredit:Shen Zihan Et fælles forskerhold ledet af prof. Zhang Huigang fra Institute of Process Engineering (IPE) v
Vulkanformet trend muliggør rationelt design af polysulfidkatalysatorer i lithium-svovlbatterierSkematisk diagram af designprincipper for højeffektive lithium-svovl-katalysatorer. Kredit:Shen Zihan Et fælles forskerhold ledet af prof. Zhang Huigang fra Institute of Process Engineering (IPE) v -
 Materialeinformatik afslører ny klasse af superhårde legeringerEt røntgenenergi-dispersiv spektroskopi (EDS) kort over den støbte mikrostruktur af en hård legering forudsagt fra Lehigh University forskeres analyse. Bogstaver er røntgenintensitetskort forbundet me
Materialeinformatik afslører ny klasse af superhårde legeringerEt røntgenenergi-dispersiv spektroskopi (EDS) kort over den støbte mikrostruktur af en hård legering forudsagt fra Lehigh University forskeres analyse. Bogstaver er røntgenintensitetskort forbundet me -
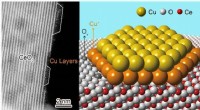 Forskere identificerer atomstruktur af katalytisk aktiv kobber-ceria-grænsefladeAtomstruktur af kobber-ceria-grænsefladen Kredit:DICP For nylig, Dr. Zhou Yan og prof. Shen Wenjie ved Dalian Institute of Chemical Physics (DICP) fra det kinesiske videnskabsakademi og deres sama
Forskere identificerer atomstruktur af katalytisk aktiv kobber-ceria-grænsefladeAtomstruktur af kobber-ceria-grænsefladen Kredit:DICP For nylig, Dr. Zhou Yan og prof. Shen Wenjie ved Dalian Institute of Chemical Physics (DICP) fra det kinesiske videnskabsakademi og deres sama -
 Forskere løser strukturen af intellektuelt handicap proteinKredit:University of Dundee Forskere ved University of Dundee har identificeret virkningerne af en mutation, der giver anledning til en form for intellektuel handicap. intellektuel funktionsnedsæ
Forskere løser strukturen af intellektuelt handicap proteinKredit:University of Dundee Forskere ved University of Dundee har identificeret virkningerne af en mutation, der giver anledning til en form for intellektuel handicap. intellektuel funktionsnedsæ
- Sand eller falsk aktiveringsenergi er kun nødvendig ved kemiske reaktioner, der frigiver energi?
- Ny hyperlimformel udviklet
- Hvor mange alleler har en ærteplante-gamete for højdegenet?
- Fanger, der idømmes flere sanktioner, er mere tilbøjelige til at begå gentagelser
- Den hollandske dommer beordrer regeringen til at gøre mere mod luftforurening
- At føle hangry er normalt, og du kan beskylde din hjerne


