Hvad sker der med molekylerne i en gas, når der påføres tryk?
1. Kollisionsfrekvens øges:
* Flere kollisioner: Molekylerne presses tættere sammen, hvilket fører til hyppigere kollisioner med hinanden og containerens vægge.
* Højere pres: Denne øgede kollisionsfrekvens er direkte ansvarlig for det højere tryk, der udøves af gassen.
2. Gennemsnitlig kinetisk energi forbliver konstant (ved konstant temperatur):
* Temperatur er nøglen: Den gennemsnitlige kinetiske energi af gasmolekylerne er direkte relateret til temperaturen. Hvis temperaturen forbliver den samme, forbliver den gennemsnitlige kinetiske energi for molekylerne konstant, selvom trykket øges.
3. Molekylær hastighedsfordeling:
* Ingen ændring i gennemsnitlig hastighed: Mens molekylernes gennemsnitlige hastighed ikke ændrer sig markant, kan fordelingen af hastigheder skifte lidt. Der er flere molekyler med højere hastigheder på grund af de øgede kollisioner.
4. Volumenreduktion (ideel gasadfærd):
* Boyle's lov: For en ideel gas er volumenet omvendt proportional med pres (Boyle's lov). Dette betyder, at når trykket øges, falder gassens volumen.
5. Tæthedsforøgelse:
* flere molekyler i det samme rum: Når gassen komprimeres, øges antallet af molekyler pr. Enhedsvolumen, hvilket resulterer i en højere densitet.
Vigtige overvejelser:
* Ægte gasser: Ægte gasser udviser afvigelser fra ideel gasadfærd ved højt tryk. Intermolekylære kræfter bliver mere markante ved højere densiteter, hvilket påvirker forholdet mellem tryk, volumen og temperatur.
* Temperatureffekter: Hvis trykforøgelsen ledsages af en temperaturstigning, vil molekylernes gennemsnitlige kinetiske energi også stige, hvilket fører til yderligere ændringer i kollisionsfrekvens og hastighed.
Kortfattet: Anvendelse af tryk på en gas får molekylerne til at kollidere oftere, hvilket fører til en stigning i tryk og et fald i volumen. Men hvis temperaturen holdes konstant, forbliver molekylernes gennemsnitlige kinetiske energi uændret.
Sidste artikelHvad er farven på te på pH -papir?
Næste artikelHvad er hybridiseringen af orbitaler omkring N atom i HNO2?
 Varme artikler
Varme artikler
-
 Hvad gør den dødbringende pufferfish så lifligForskere har identificeret de vigtigste forbindelser, der er ansvarlige for smagen af pufferfish ( Takifugu obscurus ). Kredit:Yuan Liu Nogle mennesker overvejer pufferfish, også kendt som fug
Hvad gør den dødbringende pufferfish så lifligForskere har identificeret de vigtigste forbindelser, der er ansvarlige for smagen af pufferfish ( Takifugu obscurus ). Kredit:Yuan Liu Nogle mennesker overvejer pufferfish, også kendt som fug -
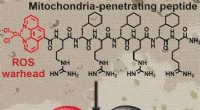 Et metallopeptid målretter og forstyrrer mitokondrielfunktionen i brystkræftstamcellerKredit:Wiley At dræbe maligne mitokondrier er en af de mest lovende fremgangsmåder i udviklingen af nye lægemidler mod kræft. Forskere fra Storbritannien har nu syntetiseret et kobberholdigt p
Et metallopeptid målretter og forstyrrer mitokondrielfunktionen i brystkræftstamcellerKredit:Wiley At dræbe maligne mitokondrier er en af de mest lovende fremgangsmåder i udviklingen af nye lægemidler mod kræft. Forskere fra Storbritannien har nu syntetiseret et kobberholdigt p -
 Cementfri beton slår korrosion og giver fatbergs skylEt fatberg udstillet i Melbourne Museum. Kredit:Copyright Museums Victoria, Fotograf:Rob Zugaro Forskere fra RMIT University har udviklet en miljøvenlig nul-cementbeton, hvilket næsten eliminerer
Cementfri beton slår korrosion og giver fatbergs skylEt fatberg udstillet i Melbourne Museum. Kredit:Copyright Museums Victoria, Fotograf:Rob Zugaro Forskere fra RMIT University har udviklet en miljøvenlig nul-cementbeton, hvilket næsten eliminerer -
 En forbedret metode til visualisering af proteinkrystalstrukturEn forbedret metode til visualisering af proteinkrystalstruktur. Kredit:Immanuel Kant Baltic Federal University Teknikken til visualisering af røntgenkrystalstruktur har været kendt i over hundred
En forbedret metode til visualisering af proteinkrystalstrukturEn forbedret metode til visualisering af proteinkrystalstruktur. Kredit:Immanuel Kant Baltic Federal University Teknikken til visualisering af røntgenkrystalstruktur har været kendt i over hundred
- Hvorfor var videnskabsmænd uenige i teorien om, hvordan kontinenterne flyttede sig?
- Minnesota flytter for at få flere elektriske køretøjer på vejene
- Hvordan man ekstraherer vand fra blæk, mælk og eddike
- Robotter, der bruges i det daglige liv
- Hvordan Islamiske Staters ødelæggelse af det gamle Palmyra udspillede sig på arabisksproget Twitt…
- Forskere opretter en meget lille sensor ved hjælp af hvidt grafen


