Hvad skete der med de forskellige partikler, når krystaller opløses i vandpartikler?
1. Tiltrækning og dissociation:
* Krystalgitter: Krystaller holdes sammen af stærke elektrostatiske kræfter (ioniske bindinger) mellem deres bestanddel ioner (ladede partikler).
* Vandmolekyler: Vand er et polært molekyle, hvilket betyder, at det har en lidt positiv ende (brintside) og en lidt negativ ende (ilt side). Disse modsatte ladninger tiltrækker ioner i krystalgitteret.
* dissociation: Tiltrækningen mellem vandmolekyler og ionerne i krystallen er stærk nok til at overvinde kræfterne, der holder krystallen sammen. Dette får krystallen til at bryde fra hinanden (dissocieres) i individuelle ioner.
2. Hydrering:
* Omgivende ioner: Når ionerne er fri i vandet, er de omgivet af vandmolekyler. De positive ender af vandmolekyler tiltrækkes af de negative ioner, og de negative ender af vandmolekyler tiltrækkes af de positive ioner.
* Hydratiseringsskal: Denne proces skaber en "hydratiseringsskal" omkring hver ion, isolerer den fra andre ioner og forhindrer krystallen i at reformere.
3. Opløsning:
* Kontinuerlig proces: Efterhånden som flere ioner er omgivet af vandmolekyler og bliver hydreret, fortsætter krystallen med at opløses.
* opløselighed: I hvilket omfang en krystal opløses afhænger af styrken af tiltrækningen mellem vandmolekyler og ionerne såvel som temperaturen på vandet. Nogle krystaller er meget opløselige (som bordsalt), mens andre næppe er opløselige (som sand).
Nøglepunkter:
* Ingen nye partikler: Opløsning skaber ikke nye partikler. Det adskiller simpelthen eksisterende ioner fra krystalgitteret og omgiver dem med vandmolekyler.
* Energiændring: Processen med at opløse en krystal kan enten frigive eller absorbere energi, afhængigt af det specifikke stof. Dette er grunden til, at nogle salte opløses og får vandet til at føle sig koldt (endotermisk), mens andre opløses og får det til at føles varmt (eksoterme).
Fortæl mig, hvis du har flere spørgsmål!
 Varme artikler
Varme artikler
-
 Neutrondiffraktionsforsøg af materialer med strukturer bestående af flere metalelementerKredit:Institut Laue-Langevin Materialer, der indeholder flere metalelementer, er vigtige til forskellige anvendelser, da kombinationen af forskellige metalkationer giver nye eller forbedrede eg
Neutrondiffraktionsforsøg af materialer med strukturer bestående af flere metalelementerKredit:Institut Laue-Langevin Materialer, der indeholder flere metalelementer, er vigtige til forskellige anvendelser, da kombinationen af forskellige metalkationer giver nye eller forbedrede eg -
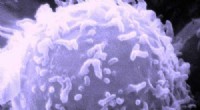 Forskere opdager en forbindelse, der er målrettet mod kræftceller, der mangler det beskyttende p53…Elektronmikroskopisk billede af en enkelt human lymfocyt. Kredit:Dr. Triche National Cancer Institute En ny kemisk forbindelse med potentiale til at ødelægge kræftceller, der er hårdt behandlede,
Forskere opdager en forbindelse, der er målrettet mod kræftceller, der mangler det beskyttende p53…Elektronmikroskopisk billede af en enkelt human lymfocyt. Kredit:Dr. Triche National Cancer Institute En ny kemisk forbindelse med potentiale til at ødelægge kræftceller, der er hårdt behandlede, -
 Forskning fjerner kulden fra isdannelse på fly og vindmøllerUBCO-forsker Mohammad Zarifi har foretaget væsentlige forbedringer af realtidssensorerne, der overvåger frost- og isopbygning på fly og turbiner. Kredit:UBCO Ny UBC Okanagan-forskning ændrer den m
Forskning fjerner kulden fra isdannelse på fly og vindmøllerUBCO-forsker Mohammad Zarifi har foretaget væsentlige forbedringer af realtidssensorerne, der overvåger frost- og isopbygning på fly og turbiner. Kredit:UBCO Ny UBC Okanagan-forskning ændrer den m -
 Tid til en ny konkurrent inden for energiomdannelse og lagringKAUST-teamet brugte state-of-the-art evolutionær søgning og beregninger af første principper til at forudsige strukturen af B 2 P 6 . Kredit:KAUST Evolutionær søgning har hjulpet forskere me
Tid til en ny konkurrent inden for energiomdannelse og lagringKAUST-teamet brugte state-of-the-art evolutionær søgning og beregninger af første principper til at forudsige strukturen af B 2 P 6 . Kredit:KAUST Evolutionær søgning har hjulpet forskere me
- Hvordan kan du bruge videnskabelig i en sætning?
- Om jord erosion
- Hvad er kromosomet, der repræsenterer kønskromosom?
- Malawi henvender sig til britiske tropper i krybskytteri
- Sikre stier:En tilgang til kontaktsporing, der tager udgangspunkt i privatlivets fred
- Automatiseret system identificerer tæt væv, en risikofaktor for brystkræft, ved mammografi


