Hvilken type element er mest sandsynligt at få elektroner, når det danner obligationer?
* Elektronkonfiguration: Ikke -metaller har generelt en næsten fuld ydre skal af elektroner. De er mere stabile, når de har en fuld ydre skal, som kan opnås ved at vinde elektroner.
* Elektronegativitet: Ikke -metaller har højere elektronegativitet end metaller. Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner. Ikke -metaller er "elektron sultne" og vil let tiltrække elektroner fra andre atomer.
Eksempler på ikke -metaller, der får elektroner i binding:
* ilt: Danner en oxidion (O²⁻) ved at få to elektroner.
* klor: Danner en chloridion (CL⁻) ved at få en elektron.
* nitrogen: Danner en nitridion (n³⁻) ved at få tre elektroner.
Bemærk: Mens nogle ikke -metaller også kan dele elektroner i kovalente bindinger, er deres tendens til at få elektroner en definerende egenskab.
 Varme artikler
Varme artikler
-
 Kan et flydende væskelignende materiale opretholde sin strukturelle orden som krystaller?Kirale krystallignende dråber, der viser ensrettet rotationsglidning. Kredit:Tokyo Tech At studere de krystallinske strukturer af organiske materialer har muliggjort betydelige fremskridt inden fo
Kan et flydende væskelignende materiale opretholde sin strukturelle orden som krystaller?Kirale krystallignende dråber, der viser ensrettet rotationsglidning. Kredit:Tokyo Tech At studere de krystallinske strukturer af organiske materialer har muliggjort betydelige fremskridt inden fo -
 Molekylære skattekort for at hjælpe med at opdage nye materialerKrystaller af et af de materialer, der blev opdaget ved hjælp af den nye metode, set med et elektronmikroskop. Dette er en struktur med en meget høj metanleveringskapacitet, hvilket gør det lovende fo
Molekylære skattekort for at hjælpe med at opdage nye materialerKrystaller af et af de materialer, der blev opdaget ved hjælp af den nye metode, set med et elektronmikroskop. Dette er en struktur med en meget høj metanleveringskapacitet, hvilket gør det lovende fo -
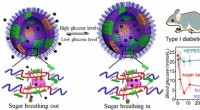 Sukkersvampe suger op og frigiver glukose efter behovKredit:American Chemical Society Mange diabetespatienter skal injicere sig selv med insulin, nogle gange flere gange om dagen, mens andre tager medicin oralt for at kontrollere blodsukkeret. Indsp
Sukkersvampe suger op og frigiver glukose efter behovKredit:American Chemical Society Mange diabetespatienter skal injicere sig selv med insulin, nogle gange flere gange om dagen, mens andre tager medicin oralt for at kontrollere blodsukkeret. Indsp -
 Forskere opdager en ny klasse af halvledende entropistabiliserede materialerKrystalstruktur af GeSnPbSSeTe, en halvledende entropistabiliseret chalcogenidlegering. De gule atomer er kationer (Ge, Sn, Pb) og de blå atomer er anioner (S, Se, Te). Forskellen i lethed svarer til
Forskere opdager en ny klasse af halvledende entropistabiliserede materialerKrystalstruktur af GeSnPbSSeTe, en halvledende entropistabiliseret chalcogenidlegering. De gule atomer er kationer (Ge, Sn, Pb) og de blå atomer er anioner (S, Se, Te). Forskellen i lethed svarer til
- Er det en kemisk forandring at skære tomater i skiver?
- Forskere kortlægger de største magnetiske felter i galaksehobe ved hjælp af synkrotronintensitets…
- Hvad er naturlige polymerer?
- Vores opdagelse af en mindre planet ud over Neptun viser, at der måske ikke er en planet ni alligev…
- At forene taxon senescence med Red Queens-hypotesen
- Hvad er fasen af nuklear membran begynder at falme fra synet?


