Hvordan er elektronkonfigurationer inden for samme gruppe ens?
Sådan er deres konfigurationer ens:
* samme antal valenselektroner: Elementer i den samme gruppe har det samme antal elektroner i deres yderste energiniveau. For eksempel har alle elementer i gruppe 1 (alkalimetaller) 1 valenselektron, mens alle elementer i gruppe 17 (halogener) har 7 valenselektroner.
* Lignende elektronkonfiguration i valensskallen: Mens de indre elektronskaller kan variere, vil den yderste skal have det samme antal elektroner og et lignende mønster af fyldte orbitaler. For eksempel slutter valensskallelektronkonfigurationen af alle gruppe 1 -elementer med * ns¹ * (hvor n er det vigtigste kvantetal).
Eksempel:
Lad os se på gruppe 1 (alkalimetaller):
* lithium (Li): 1S² 2S¹
* natrium (NA): 1S² 2S² 2P⁶ 3S¹
* kalium (k): 1S² 2S² 2P⁶ 3S² 3P⁶ 4S¹
Bemærk, at antallet af valenselektroner altid er 1, og konfigurationen slutter altid med *ns¹ *.
Betydning:
Lighederne i elektronkonfiguration inden for en gruppe forklarer, hvorfor elementer i den samme gruppe ofte udviser lignende kemiske egenskaber. Deres lignende valenselektronkonfigurationer fører til lignende reaktivitet og bindingsadfærd.
Bemærk: Lighederne i elektronkonfiguration bliver mindre udtalt, når du bevæger dig ned ad en gruppe på grund af det stigende antal indre skaller. Imidlertid forbliver det grundlæggende princip for at have det samme antal valenselektroner sandt.
Sidste artikelHvad er asymmetrisk sammensætning?
Næste artikelHvad er det omtrentlige kogetryk af kølemiddelolie i systemet?
 Varme artikler
Varme artikler
-
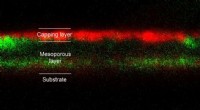 Afslører den skjulte vej for perovskitdannelseTværsnitsfotoluminescenskort af en delvist reageret prøve. Emission mellem 500 og 550 nm tilskrevet blyiodid er vist med grønt, mens emissionen mellem 700 og 800 nm tilskrevet perovskit er vist med rø
Afslører den skjulte vej for perovskitdannelseTværsnitsfotoluminescenskort af en delvist reageret prøve. Emission mellem 500 og 550 nm tilskrevet blyiodid er vist med grønt, mens emissionen mellem 700 og 800 nm tilskrevet perovskit er vist med rø -
 Platinkompleks hæmmer metastase gennem konformationel modulering af heparansulfatKredit:Angewandte Chemie Cisplatin har været brugt til behandling af kræft siden 1970erne. Siden da, mange andre platinholdige cytostatika er blevet udviklet, såsom triplatinNC, et stærkt ladet ko
Platinkompleks hæmmer metastase gennem konformationel modulering af heparansulfatKredit:Angewandte Chemie Cisplatin har været brugt til behandling af kræft siden 1970erne. Siden da, mange andre platinholdige cytostatika er blevet udviklet, såsom triplatinNC, et stærkt ladet ko -
 Årsag til katodenedbrydning identificeret for nikkelrige materialerMedlemmer af Brookhaven-teamet vises ved NSLS-IIs ISS-strålelinje, hvor en del af undersøgelsen blev udført. På billedet forfra og bagfra ses Eli Stavitski, Xiao-Qing Yang, Xuelong Wang, og Enyuan Hu.
Årsag til katodenedbrydning identificeret for nikkelrige materialerMedlemmer af Brookhaven-teamet vises ved NSLS-IIs ISS-strålelinje, hvor en del af undersøgelsen blev udført. På billedet forfra og bagfra ses Eli Stavitski, Xiao-Qing Yang, Xuelong Wang, og Enyuan Hu. -
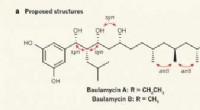 Kemikere udleder den korrekte struktur af A- og B-baulamycinerneTidligere foreslåede og faktiske molekylære strukturer af baulamycinerne. Kredit: Natur (2017). doi:10.1038/nature23265 (Phys.org) – Et team af kemikere ved University of Bristol har korrekt udle
Kemikere udleder den korrekte struktur af A- og B-baulamycinerneTidligere foreslåede og faktiske molekylære strukturer af baulamycinerne. Kredit: Natur (2017). doi:10.1038/nature23265 (Phys.org) – Et team af kemikere ved University of Bristol har korrekt udle
- Hvad er de almindelige gasser, der bruges i GMAW -processen?
- Hvad ville Optimus Prime gøre? Ny forskning anvender Transformers for at kaste lys over virksomheds…
- Hvordan er input- og outputkræfterne for dele en sammensat maskine relateret?
- COVID muterer hurtigt i hvidhalehjort, men her er grunden til, at vi ikke behøver at bekymre os - f…
- Hvordan laver man caco3 ch3cooh til en dobbelt forskydningsreaktion?
- Den første amerikanske månelander i et halvt århundrede holder op med at arbejde en uge efter at …


