Hvorfor adskiller egenskaberne ved natriumchlorid sig fra metal- og klorgas?
Her er en sammenbrud:
natrium (NA):
* metal: Blød, sølvhvid, meget reaktiv, leder elektricitet og varme godt.
* reagerer kraftigt med vand: Frigiver brintgas og danner en stærkt alkalisk opløsning.
klor (CL):
* gas: Gulgrøn, skarp, giftig, meget reaktiv.
* stærk oxidation: Kan reagere med mange stoffer, der fører til ild eller eksplosioner.
natriumchlorid (NaCl):
* fast: Hvid krystallinsk, sprød, ikke-toksisk, udfører ikke elektricitet i fast form, opløstes let i vand.
Hvorfor forskellen?
* ionisk binding: Natrium og klor reagerer voldsomt, hvor natrium opgiver et elektron til klor. Dette skaber positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-).
* stærk elektrostatisk attraktion: De modsatte ladede ioner tiltrækkes af hinanden og danner en krystalgitterstruktur. Denne stærke elektrostatiske kraft er det, der giver natriumchlorid sine unikke egenskaber.
Sådan er egenskaberne forskellige:
* reaktivitet: Natriumchlorid er meget mindre reaktiv end hverken natrium eller klor. Den ioniske binding stabiliserer ionerne, hvilket gør dem mindre tilbøjelige til at deltage i yderligere reaktioner.
* Matterilat: De stærke ioniske bindinger i natriumchlorid skaber et fast stof ved stuetemperatur. Dette er i modsætning til det metalliske natrium, der er solidt, og klor, som er en gas.
* Konduktivitet: Natriumchlorid udfører elektricitet, når den opløstes i vand, fordi ionerne er frit at bevæge sig. I sin faste form er ionerne imidlertid låst i krystalgitteret og kan ikke bevæge sig frit. Dette er forskelligt fra metallisk natrium, der udfører elektricitet i fast form.
* toksicitet: Klorgas er giftigt, mens natriumchlorid er ikke-toksisk. Den ioniske binding ændrer de konstituerende elementers reaktivitet og toksicitet markant.
I det væsentlige ændrer dannelsen af ioniske bindinger drastisk de kemiske og fysiske egenskaber ved natrium og klor, hvilket resulterer i et helt andet stof med sine egne unikke egenskaber.
Sidste artikelHvorfor er nedbrydning af et æble en kemisk ændring?
Næste artikelHvorfor er Xenon mere reaktiv end andre ædelgasser?
 Varme artikler
Varme artikler
-
 Ultrahurtige elektroner i magnetiske oxider:En ny retning for spintronics?Kredit:CC0 Public Domain Særlige metaloxider kan en dag erstatte halvledermaterialer, der almindeligvis bruges i dag i processorer. Nu, for første gang, et internationalt forskerteam fra Martin Lu
Ultrahurtige elektroner i magnetiske oxider:En ny retning for spintronics?Kredit:CC0 Public Domain Særlige metaloxider kan en dag erstatte halvledermaterialer, der almindeligvis bruges i dag i processorer. Nu, for første gang, et internationalt forskerteam fra Martin Lu -
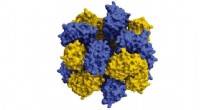 Supercomputere hjælper med at samle proteinerVed hjælp af supercomputere, forskere er lige begyndt at designe proteiner, der samler sig for at kombinere og ligne livgivende molekyler som hæmoglobin. Kredit:Taylor et al. Røde blodlegemer er f
Supercomputere hjælper med at samle proteinerVed hjælp af supercomputere, forskere er lige begyndt at designe proteiner, der samler sig for at kombinere og ligne livgivende molekyler som hæmoglobin. Kredit:Taylor et al. Røde blodlegemer er f -
 Hele forestillingen, intet af balladen:nitrilhydrogenering udført rigtigtFigur 1:Katalytisk hydrogenering af nitriler til primære aminer. Kredit:Osaka University Behovet for at være opmærksomme forbrugere er ved at blive en prioritet for en stadigt voksende del af samf
Hele forestillingen, intet af balladen:nitrilhydrogenering udført rigtigtFigur 1:Katalytisk hydrogenering af nitriler til primære aminer. Kredit:Osaka University Behovet for at være opmærksomme forbrugere er ved at blive en prioritet for en stadigt voksende del af samf -
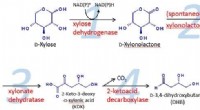 Metabolisk ingeniørmetode lykkes med at producere 1, 2, 4-butantetriol bæredygtigt fra biomasseFigur 1:Diagram over reaktionsprocessen. Kredit:Kobe University En mere miljøvenlig og bæredygtig metode til fremstilling af det nyttige kemikalie 1, 2, 4-butantetriol er blevet opdaget. Kobe -uni
Metabolisk ingeniørmetode lykkes med at producere 1, 2, 4-butantetriol bæredygtigt fra biomasseFigur 1:Diagram over reaktionsprocessen. Kredit:Kobe University En mere miljøvenlig og bæredygtig metode til fremstilling af det nyttige kemikalie 1, 2, 4-butantetriol er blevet opdaget. Kobe -uni
- Derfor har verden brug for en bedre LED-pære
- Genopfatte uddannelse til nutidens komplekse og hurtigt skiftende verden
- Fysikere forbedrer metode til at designe fusionsforsøg
- Et nyt blik på solpletter
- OSIRIS-billeder af Rosettas komet viser spektakulære strømme, støv, der udsendes i rummet
- Afsløring af den sjældne forekomst af orkanen Californien


