Hvorfor er Xenon mere reaktiv end andre ædelgasser?
* stor atomstørrelse: Xenon har den største atomradius blandt de ædle gasser. Dette betyder, at dens yderste elektroner er længere væk fra kernen og mindre tæt holdt, hvilket gør dem mere modtagelige for interaktioner med andre atomer.
* lavere ioniseringsenergi: Xenon har en lavere ioniseringsenergi end andre ædelgasser. Dette betyder, at det kræver mindre energi at fjerne et elektron fra et Xenon -atom, hvilket gør det mere sandsynligt at danne bindinger med andre elementer.
* relativt svag afskærmning: Xenons yderste elektroner oplever mindre afskærmning fra de indre elektroner, hvilket gør dem mere modtagelige for interaktioner med andre atomer.
På grund af disse faktorer kan Xenon danne forbindelser med elementer som fluor, ilt og endda carbon, som var en banebrydende opdagelse i kemi. Mens Xenon er den mest reaktive af de ædle gasser, er det stadig markant mindre reaktivt end elementer i andre grupper på den periodiske tabel.
Her er en sammenligning af reaktiviteten af de ædle gasser:
* Xenon (XE): Mest reaktive
* radon (RN): Reaktiv, men radioaktivt
* krypton (KR): Mindre reaktiv end XE
* argon (AR): Endnu mindre reaktiv end kr
* neon (NE): Meget ureaktiv
* helium (He): Den mindst reaktive
Så selvom Xenon er den mest reaktive af de ædle gasser, betragtes det stadig som et relativt ureaktivt element sammenlignet med de fleste andre elementer på det periodiske tabel.
Sidste artikelHvorfor adskiller egenskaberne ved natriumchlorid sig fra metal- og klorgas?
Næste artikelHvordan har du plastmetallisering?
 Varme artikler
Varme artikler
-
 Ny indsigt i A-vitamin genbrug og dagtidssynSynsvurdering hos zebrafisk:Hvis de fem dage gamle larver ser de sorte og hvide striber rotere, de bevæger deres øjne for at følge bevægelsen. Kredit:UCD Research and Innovation Mange mennesker hu
Ny indsigt i A-vitamin genbrug og dagtidssynSynsvurdering hos zebrafisk:Hvis de fem dage gamle larver ser de sorte og hvide striber rotere, de bevæger deres øjne for at følge bevægelsen. Kredit:UCD Research and Innovation Mange mennesker hu -
 Godt forbundet gennem amiderKredit:CC0 Public Domain Sammenkobling af molekylære komponenter gennem amidbindinger er en af de vigtigste reaktioner i forskning og den kemiske industri. I journalen Angewandte Chemie , fors
Godt forbundet gennem amiderKredit:CC0 Public Domain Sammenkobling af molekylære komponenter gennem amidbindinger er en af de vigtigste reaktioner i forskning og den kemiske industri. I journalen Angewandte Chemie , fors -
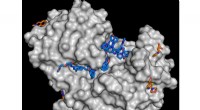 Nyt stofbibliotek for at fremskynde søgningen efter aktive stofferTil studiet, enzymet endothiapepsin (grå) blev kombineret med molekyler fra fragmentbiblioteket. Analysen viser, at adskillige stoffer er i stand til at koble sig til enzymet (blå og orange molekyler)
Nyt stofbibliotek for at fremskynde søgningen efter aktive stofferTil studiet, enzymet endothiapepsin (grå) blev kombineret med molekyler fra fragmentbiblioteket. Analysen viser, at adskillige stoffer er i stand til at koble sig til enzymet (blå og orange molekyler) -
 At se nærmere på genetiske skift i kræftEn krystalstruktur af en del af menneskelig DPF2, et protein, der styrer en genetisk switch, der fortæller blodstamceller, hvornår de skal blive røde og hvide blodlegemer. Orange og gule områder illus
At se nærmere på genetiske skift i kræftEn krystalstruktur af en del af menneskelig DPF2, et protein, der styrer en genetisk switch, der fortæller blodstamceller, hvornår de skal blive røde og hvide blodlegemer. Orange og gule områder illus
- Vejreksperter:Mangel på planlægning forårsagede kold katastrofe
- Skydråbernes hemmelige liv
- Er planeter med oceaner almindelige i galaksen? Det er sandsynligt, finder NASA-forskere
- Sådan beregnes procentforskel
- Et hastværk er på vej til at mine den dybe havbund, med virkninger på havets liv, som ikke er god…
- Stemmeassistenter skal opbygge tillid, før de var fortrolige med, at de sporede os


